
| A. | 反应开始时,盐酸与锌反应放出氢气的速率更快 | |
| B. | 盐酸和醋酸分别与锌完全反应所需时间一样长 | |
| C. | 醋酸与锌反应放出的氢气多 | |
| D. | 盐酸和醋酸分别与锌反应放出的氢气一样多 |
分析 pH=2,则H+浓度均为0.01mol/L,pH均等于2的盐酸和醋酸,氯化氢是强电解质,醋酸是弱电解质,所以c(CH3COOH)>c(HCl),等pH等体积的盐酸和醋酸,n(CH3COOH)>n(HCl),盐酸和醋酸分别与足量锌反应时,酸的物质的量越多,生成氢气的量越大,酸与锌反应速率与氢离子浓度有关,氢离子浓度越大,反应速率越大,以此解答该题.
解答 解:A.当pH=2的盐酸和醋酸稀释2倍后,醋酸中氢离子浓度大于盐酸,所以醋酸反应速率大,故A错误;
B.醋酸浓度较大,反应速率较大,所需时间不等,故B错误;
C.醋酸物质的量较多,与锌反应生成氢气较多,故C正确;
D.等pH等体积的盐酸和醋酸,n(CH3COOH)>n(HCl),盐酸和醋酸分别与足量锌反应时,酸的物质的量越多,生成氢气的量越大,所以醋酸和锌反应生成的氢气比盐酸生成的氢气多,故D错误.
故选C.
点评 本题考查弱电解质电离,为高频考点,侧重于学生的分析能力的考查,明确生成的氢气和酸的关系、反应速率和氢离子浓度关系即可解答,难度不大.


科目:高中化学 来源: 题型:解答题
 四氧化三锰(Mn3O4)在电子工业有广泛应用.
四氧化三锰(Mn3O4)在电子工业有广泛应用.| 序号 | 反应 | △H(kJ•mol-1) | K | |
| 300°C | 800°C | |||
| Ⅰ | MnCO3(s)+$\frac{1}{2}$O2(g)?MnO2(s)+CO2(g) | a | 3.0×107 | 1.8×105 |
| Ⅱ | MnCO3(s)+$\frac{1}{4}$O2(g)?$\frac{1}{2}$Mn2O3(s)+CO2(g) | b | 1.7×103 | 2.4×105 |
| Ⅲ | MnCO3(s)+$\frac{1}{6}$O2(g)?$\frac{1}{3}$Mn3O4(s)+CO2(g) | c | 9.8 | 9.6×104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
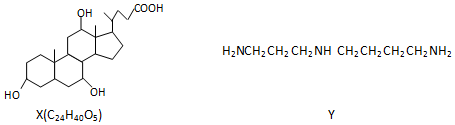
| A. | 1molX在浓硫酸作用下发生消去反应,最多生成3molH2O | |
| B. | 1molY发生类似酯化的反应,最多消耗2molX | |
| C. | X与足量HBr反应,所得有机物的分子式为C24H37O2Br3 | |
| D. | Y与癸烷的分子链均呈锯齿形,但Y的极性较强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素单质的熔点按F2、Cl2、Br2、I2的顺序依次减小 | |
| B. | 卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易 | |
| C. | 卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深 | |
| D. | 卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与NaOH溶液完全反应,转移电子数为2NA | |
| B. | 100g36.5%的盐酸中含HCl分子为NA | |
| C. | 1.12LCl2含有1.7NA个质子 | |
| D. | 56gFe与足量的Cl2完全反应,消耗Cl2分子数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为△H=-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ•mol-1 | |
| C. | 一定条件下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 同温同压下,反应H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com