
分析 存在元素化合价变化的反应属于氧化还原反应,水只做氧化剂,则水中H元素的化合价降低;水只做还原剂,则水中O元素的化合价升高;水中H、O元素的化合价变化,则水既不做氧化剂又不做还原剂,结合氧化还原反应的概念分析.
解答 解:①2Na+2H2O=2NaOH+H2↑ 中,水中H元素的化合价降低,则水为氧化剂;
②2Na2O2+2H2O=4NaOH+O2↑反应中,过氧化钠中的O元素变价,水中的O、H元素没有发生化合价的变化,水既不做氧化剂又不做还原剂;
③Na2O+H2O=2NaOH 反应中没有元素化合价的变化,不是氧化还原反应;
④2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑中,H元素的化合价降低,O元素的化合价升高,则水既是氧化剂也是还原剂;
⑤2F2+2H2O=4HF+O2中,水中O元素的化合价升高,则水为还原剂;
(1)其中不属于氧化还原反应的是 ③;
故答案为:③;
(2)水只作氧化剂的反应是①;只作还原剂的反应是⑤;水既作氧化剂,又作还原剂是④;水既不作氧化剂,又不作还原剂是②;
故答案为:①、⑤、④、②;
(3)3NO2+H2O=2HNO3反应中,N元素的化合价发生变化,属于氧化还原反应;反应中N元素的化合价既升高又降低,所以NO2既是氧化剂也是还原剂;
故答案为:是;NO2;NO2.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中还原剂、氧化剂判断的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na2O2与水反应制O2,每生成0.25molO2转移电子数为1NA | |
| B. | 等物质的量的N2和CO所含原子数均为2NA | |
| C. | 在标准状况下,11.2L HCHO所含的分子数约为0.5NA | |
| D. | 1molSO2与足量的O2反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32g氧气所含的原子数目为2NA | |
| B. | 标准状况下,22.4LH2O含有的分子数为NA | |
| C. | 5.6gFe和足量的盐酸反应时,失去的电子数为0.3NA | |
| D. | 0.5mol/L的MgCl2溶液中,含有Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
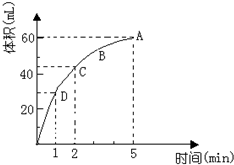 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有③ | B. | ②③ | C. | ③⑤ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com