
| A.食盐和蔗糖熔化 | B.钠和硫熔化 |
| C.碘和干冰升华 | D.二氧化硅和氧化钠熔化 |
科目:高中化学 来源:不详 题型:填空题
| 物质 | A | NaCl | KCl | CsCl |
| 熔点/K | | 1074 | 1049 | 918 |
| 物质 | B | Na | Mg | Al |
| 熔点/K | | 317 | 923 | 933 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
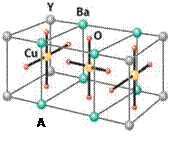
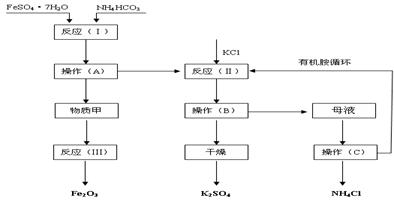
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.含有金属元素的晶体不一定是离子晶体 |
| B.CO2和CH4都是由极性键构成的非极性分子 |
| C.HF、HCl、HBr、HI四种物质的沸点依次升高 |
| D.NaHSO4溶于水时既有离子键断裂又有共价键断裂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
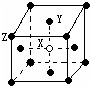
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com