
【题目】氮及其化合物在工业生产中有广泛用。
(1)稀硝酸与二价活泼金属M反应制备硝酸盐,当反应物之比n(HNO3)∶n(M)=5∶2时,还原产物为___(填化学式)。
(2)连二次硝酸(HO-N=N-OH)是一种二元弱酸,向0.1 mol·L-1连二次硝酸钠(Na2N2O2)溶液中滴加酚酞,溶液变红色 ,用离子方程式表示其主要原因:__________________。
(3)已知以下热化学方程式: 2N2O5(g)![]() 4NO2(g)+O2(g) ΔH1
4NO2(g)+O2(g) ΔH1
2NO(g)+O2(g)=2NO2(g) ΔH2
3NO2(g)![]() N2O5(g)+NO(g) ΔH3
N2O5(g)+NO(g) ΔH3
①ΔH3=______________________(用ΔH1、ΔH2表示)。
②一定温度下,在恒容密闭容器中进行反应:3NO2(g)![]() N2O5(g)+NO(g),下列表明反应已达到平衡状态的是________。
N2O5(g)+NO(g),下列表明反应已达到平衡状态的是________。
A.容器内总压强保持不变 B.容器内气体密度保持不变
C.v正(NO2)∶v逆(N2O5)=3∶1 D.![]() 保持不变
保持不变
(4)在密闭容器中充入NO,发生反应2NO(g)![]() N2(g)+O2(g) ΔH,达到平衡之后,升高温度,平衡常数K减小。
N2(g)+O2(g) ΔH,达到平衡之后,升高温度,平衡常数K减小。
①ΔH________0。(填“>”“<”或“=”)
②上述反应达到平衡之后,仅缩小容器体积,下列推断正确的是_________。
A.NO的浓度不再变化
B.NO的转化率不再变化
C.正、逆反应速率不再变化
D.容器内气体压强不再变化
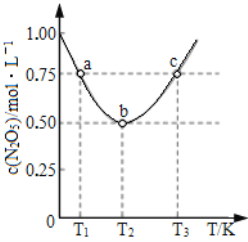
(5)在2 L恒容密闭容器中投入一定量的N2O5(g),发生反应:2N2O5(g)![]() 4NO2(g)+O2(g),测得c(N2O5)与温度关系如图所示。T2 K时,该反应的平衡常数K为_________。若平衡时温度不变,再向容器中充入少量的N2O5气体,达到新平衡时N2O5的转化率会_________(填“增大”“减小”或“不变”)。
4NO2(g)+O2(g),测得c(N2O5)与温度关系如图所示。T2 K时,该反应的平衡常数K为_________。若平衡时温度不变,再向容器中充入少量的N2O5气体,达到新平衡时N2O5的转化率会_________(填“增大”“减小”或“不变”)。
【答案】 N2O或NH4NO3 N2O22-+H2O![]() HN2O2-+OH- -
HN2O2-+OH- - ![]() ACD < B 1 mol3·L-3 减小
ACD < B 1 mol3·L-3 减小
【解析】试题(1)因为金属为2价,所以氧化后需要2摩尔的硝酸和金属结合,又因为金属与硝酸所消耗的物质的量的比为2:5,所以2摩尔的金属就需要4摩尔的硝酸形成盐,那么还有1摩尔的硝酸被还原;若还原产物是硝酸铵,则被还原的硝酸是0.5mol。(2)向0.1 mol·L-1连二次硝酸钠(Na2N2O2)溶液中滴加酚酞,溶液变红色,说明Na2N2O2是强碱弱酸盐,N2O22-水解;(3)①根据盖斯定律计算ΔH3;②根据平衡标志分析;(4) ①升高温度,平衡常数K减小,说明平衡逆向移动;②反应前后气体物质的量是相等,反应达到平衡之后,仅缩小容器体积,平衡不移动;(5)利用“三段式”计算平衡常数;再向容器中充入少量的N2O5气体,相当于加压;
解析:(1)因为金属为2价,所以氧化后需要2摩尔的硝酸和金属结合,又因为金属与硝酸所消耗的物质的量的比为2:5,所以2摩尔的金属就需要4摩尔的硝酸形成盐,那么还有1摩尔的硝酸被还原,设还原产物中N元素的化合价是x,根据得失电子守恒2×2=1×(5-x);x=+1,所以还原产物是N2O;若还原产物是硝酸铵,则被还原的硝酸是0.5mol,N元素化合价由+5降低为-3,所以原产物可能是硝酸铵。(2)向0.1 mol·L-1连二次硝酸钠(Na2N2O2)溶液中滴加酚酞,溶液变红色,说明Na2N2O2是强碱弱酸盐,N2O22-水解,水解离子方程式是N2O22-+H2O![]() HN2O2-+OH-;(3)①2N2O5(g)
HN2O2-+OH-;(3)①2N2O5(g)![]() 4NO2(g)+O2(g) ΔH1;②2NO(g)+O2(g)=2NO2(g) ΔH2
4NO2(g)+O2(g) ΔH1;②2NO(g)+O2(g)=2NO2(g) ΔH2
根据盖斯定律―①×![]() ―②×
―②×![]() 得3NO2(g)
得3NO2(g)![]() N2O5(g)+NO(g) ΔH3=-
N2O5(g)+NO(g) ΔH3=- ![]() ;②A.反应前后气体物质的量是变量,所以容器内总压强保持不变达到平衡状态,故A正确; B.容器内气体质量不变,根据
;②A.反应前后气体物质的量是变量,所以容器内总压强保持不变达到平衡状态,故A正确; B.容器内气体质量不变,根据![]() ,密度是恒量,所以容器内气体密度保持不变,不一定平衡,故B错误; C.根据v正(NO2)∶v逆(N2O5)=3∶1,正逆反应速率比等于系数比,一定达到平衡状态,故C正确; D.Q=
,密度是恒量,所以容器内气体密度保持不变,不一定平衡,故B错误; C.根据v正(NO2)∶v逆(N2O5)=3∶1,正逆反应速率比等于系数比,一定达到平衡状态,故C正确; D.Q=![]() ,Q不变时,即Q=K时,达到平衡状态,故D正确; (4) ①升高温度,平衡常数K减小,说明平衡逆向移动,所以正反应放热,ΔH<0;②2NO(g)
,Q不变时,即Q=K时,达到平衡状态,故D正确; (4) ①升高温度,平衡常数K减小,说明平衡逆向移动,所以正反应放热,ΔH<0;②2NO(g)![]() N2(g)+O2(g)反应达到平衡之后;A.仅缩小容器体积,NO的浓度增大,故A错误; B. 反应前后气体物质的量是相等,反应达到平衡之后,仅缩小容器体积,平衡不移动,所以NO的转化率不变化,故B正确; C.缩小容器体积,压强增大,所以正、逆反应速率均增大,故C错误; D.缩小容器体积,压强增大,故D错误。(5)根据图示,T2K时N2O5的浓度是0.5mol/L,
N2(g)+O2(g)反应达到平衡之后;A.仅缩小容器体积,NO的浓度增大,故A错误; B. 反应前后气体物质的量是相等,反应达到平衡之后,仅缩小容器体积,平衡不移动,所以NO的转化率不变化,故B正确; C.缩小容器体积,压强增大,所以正、逆反应速率均增大,故C错误; D.缩小容器体积,压强增大,故D错误。(5)根据图示,T2K时N2O5的浓度是0.5mol/L,
![]() mol3·L-3 ;再向容器中充入少量的N2O5气体,相当于加压,达到新平衡时N2O5的转化率会减小。
mol3·L-3 ;再向容器中充入少量的N2O5气体,相当于加压,达到新平衡时N2O5的转化率会减小。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】关于卤族元素的下列说法正确的是
A. 所有卤族元素的微粒都易得电子
B. 和氟同一主族的元素都是非金属元素
C. 化合物中卤族元素都显负价
D. 卤族元素原子的原子半径从上到下逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列五种物质:①CO2;②NH3;③SO2;④H2SO4;⑤NaCl。
(1)其中,能使品红溶液退色的是_____________(填序号,下同);
(2)属于电解质的是_____________ ;
(3)只含离子键的是________________;
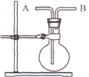
(4)利用下图装置并从B口进气,可收集的气体是___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2气体缓缓地通入含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物 质的量与所通CO2的体积关系如图所示。下列关于整个反应过程中的描述不正确的是

A. O~a段反应的化学方程式是Ba(OH)2+CO2![]() BaCO3↓+H2O
BaCO3↓+H2O
B. a~b段反应的离子方程式是2OH-+CO2![]() CO32-+H2O
CO32-+H2O
C. a~b段与c~d段所发生的反应相同
D. d~e段沉淀减少是由于碳酸钡固体溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
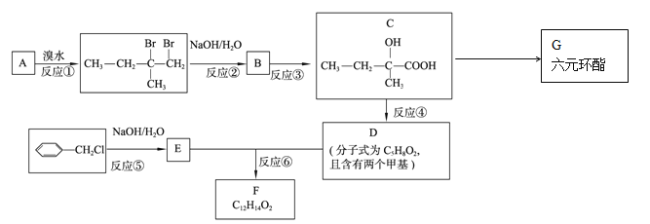
【题目】(有机化学基础)分子式为C12H14O2的有机物F广泛用于制备香精的调香剂。为了合成该有机物,某实验室的科技人员设计了下列合成路线。
 试回答下列问题:
试回答下列问题:
(1)A物质名称为(系统命名) 。
(2)合成路线中反应③所属反应类型为 。
(3)有机物G的结构简式为 。
(4)有机物D中所含官能团的名称为 。
(5)关于有机物C,下列说法正确的是( )
A.等物质的量的C分别与足量的金属钠和NaHCO3反应,后者产生气体多
B.一定条件下,有机物C能通过缩聚反应形成高分子化合物
C.1molC完全燃烧生成CO2和H2O,消耗的氧气的物质的量为6mol
D.有机物C中的所有碳原子可能在同一平面上
(6)反应⑥的化学反应方程式为 。
(7)F有多种同分异构体,请写出符合下列条件的所有同分异构体的结构简式:①属于芳香族化合物,且含有与F相同的官能团;②苯环上有两个取代基,且苯环上的一氯代物只有两种;③其中一个取代基为-CH2COOCH3; 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化钠、氢氧化钙的溶液都具有相似的化学性质,其原因是( )
A.都能电离出金属离子B.都能与酸反应生成盐和水
C.都能使无色酚酞溶液变成红色D.溶液中都含有OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,互为同分异构体的是
A. 金刚石和石墨
B. 丙醇和甲乙醚
C. CH3-CH2-CH2-COOH和CH3-CH2-CH2-CH2-COOH
D. 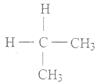 和
和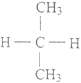
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z均为短周期元素组成的物质,其转化关系如下:
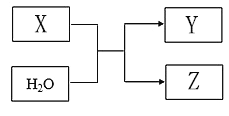
请回答:
(1)若X为淡黄色固体,Z是单质。
①组成Z的元素在周期表中的位置是_____。
②取少量X与水反应,下列叙述正确的是_____(填字母)。
a.该反应是氧化还原反应
b.向反应后的溶液中滴加酚酞试剂,溶液变红
c.当有1 molX参加反应时,共转移2mol电子
(2)若X由两种元素组成,其中一种元素的最外层电子数比电子层数多3,另一种是地壳中含量最多的元素。Y与X的组成元素相同。
①X与水反应的化学方程式为_____。
②X与O2混合通入水中,恰好生成4molZ,则通入的X为____mol,O2为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活等息息相关,下列说法中错误的是( )
A. 我国自主研发的东方超环(人造太阳)使用的2H、3H与1H互为同位素
B. 明矾能用于自来水的消毒杀菌
C. “华为P30pro”手机中麒麟芯片的主要成分是单质硅
D. 港珠澳大桥采用的超高分子量聚乙烯纤维吊绳,是有机高分子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com