
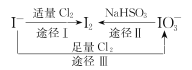
【题目】I-具有还原性,含碘食盐中的碘元素主要以KIO3的形式存在,I-、I2、IO3-在一定条件下可发生如图转化关系,下列说法不正确的是
A.用淀粉-KI试纸和食醋可检验食盐是否加碘
B.由图可知氧化性的强弱顺序为Cl2>IO3->I2
C.生产等量的碘,途径I和途径II转移电子数目之比为5 :2
D.途径III反应的离子方程式:3Cl2+I-+3H2O=6Cl-+IO3-+6H+
【答案】C
【解析】
A. KIO3、KI在酸性条件下发生氧化还原反应产生I2,I2遇淀粉溶液变为蓝色,因此可以用淀粉-KI试纸和食醋可检验食盐是否加碘,A正确;
B. 由途径I可知氧化性Cl2>I2,由途径II可知氧化性:IO3->I2,由途径III可知氧化性:Cl2>IO3-,故物质氧化性有强到弱的顺序为:Cl2>IO3->I2,B正确;
C. 假设反应产生1 molI2,途径I转移2 mol电子,途径II转移10 mol电子,因此生产等量的碘,途径I和途径II转移电子数目之比为2 :10=1:5,C错误;
D. 途径III中,Cl2把I-氧化为IO3-,Cl2被还原为Cl-,根据电子守恒、电荷守恒、原子守恒,可得反应的离子方程式:3Cl2+I-+3H2O=6Cl-+IO3-+6H+,D正确;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是( )
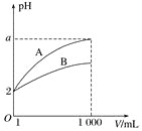
A.A、B两酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液的酸性强
C.a=5时,A是强酸,B是弱酸
D.一定有关系:5>a>2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将N2、H2混合气体100 mL通入密闭容器内,达到平衡时,容器内的压强比反应前减小![]() ,测得此时混合气体的平均相对分子质量为9。试求:
,测得此时混合气体的平均相对分子质量为9。试求:
(1)原混合气中N2、H2各多少毫升______?
(2)H2的转化率是多少______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A(C9H9O3Br)可以发生如图所示的转化,合成两种重要的高分子化合物G和H(其他产物和水已略去)。
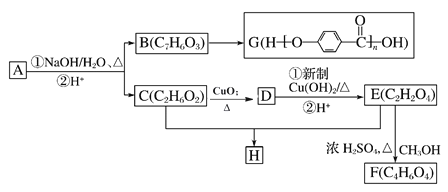
已知A遇氯化铁溶液显紫色,请回答下列问题:
(1)B的结构简式为____________,其核磁共振氢谱图显示有______种不同环境的氢原子。
(2)D的名称是________________;C和E生成H的反应类型为 _______________
(3)1molA与足量NaOH 溶液充分反应,消耗NaOH的物质的量为____________
(4)C生成D的化学方程式为________________________
(5)W是B的同系物,比B多一个碳原子, 符合下列条件的W的同分异构体有______种。
①遇氯化铁溶液显紫色
②既能发生水解反应又能发生银镜反应
(6)参照上述合成路线,根据信息,以乙醇为原料(无机试剂任选)设计制备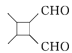 的合成路线_______________
的合成路线_______________
ⅰ.![]()
![]()
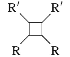
![]() +H2O(R1、R2为烃基或氢)
+H2O(R1、R2为烃基或氢)
ⅱ.R-HC![]() CH-R'
CH-R'![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.pH =1的H2SO4溶液中SO42-的数目为0.5NA
B.1 mol金刚石中C-C数目为4NA
C.12.0 g NaHSO4晶体中阴阳离子数目为0.3NA
D.2.3 g Na与过量O2反应转移电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为:正极:_____________________________ ;负极:______________________。
(2)为了降低某水库铁闸门被腐蚀的速率,可以采用甲图所示的方案,其中焊接在闸 门上的固体材料R可以采用___________。
A.铜 B.钠 C.锌 D.石墨
(3)乙图所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的___________极。

(4)铅蓄电池是化学电源,其电极材料分别为Pb和PbO2,电解质溶液为稀硫酸,放电时电池的总反应为Pb + PbO2 + 2H2SO4== 2PbSO4 + 2H2O。根据上述情况判断:
①铅蓄电池的正极材料是_______(填“Pb”或“PbO2”),负极的电极反应式为_______________________________________。
②铅蓄电池工作时,电解质溶液中SO42﹣移向________极(填“负”或“正”),溶液的pH___________ (填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表的另一种画法——塔式周期表,上面标有部分族及部分元素。请根据周期表中所列的元素回答问题:
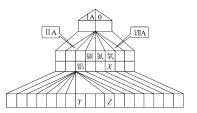
(1)碳、氮、氧三种元素的电负性由小到大的顺序为_____________________。
(2)Y3+的结构示意图为_____________,Z的价电子排布式为_______________。
(3)原子簇是由几个到几百个原子组成的相对独立的物质结构单元,如铝原子簇Al13、Al14。已知原子簇价电子总数为2,8,20,34,40,58……时,原子簇可稳定存在。
①Al13的化学性质与第__________族元素性质相似
②Al14达到稳定时,呈现的化合价为+2,其原因是___________________。

(4)某种化合物由X、Y、Z三种元素组成,其晶胞结构如图所示,则其化学式为____________,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:ρ=_______gcm-3(只要求列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表(单位省略):
醋酸 | 碳酸 | 氢氰酸 |
Ka=1.7×10-5 | Ka1=4.2×10-7 Ka2=5.6×10-11 | Ka=6.2×10-10 |
(1)写出碳酸的第一步电离方程式___。
(2)25℃时,等浓度的三种溶液①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,pH由大到小的顺序为___(填序号)。
(3)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为___。
(4)将浓度为0.02mol/L的HCN与0.01mol/LNaOH溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是___。
a.c(H+)>c(OH-) b.c(H+)+c(HCN)=c(OH-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl溶液中,阴离子总浓度由大到小的顺序为___(填序号)。
Ⅱ.酸性高锰酸钾标准溶液是实验室常用的氧化还原滴定标准试剂。
(6)某同学用0.1000mol/L的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑。
①滴定时,用___装KMnO4溶液。
②滴定到达终点的现象是___。
③用移液管吸取25.00m试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 17.00 | 16.90 |
则试样中过氧化氢的浓度为___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+,O2,NO3-等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。下列说法错误的是( )
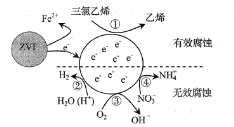
A. 反应①②③④均在正极发生
B. 单位时间内,三氯乙烯脱去amolCl时ne=amol
C. ④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D. 增大单位体积水体中小粒径ZVI的投入量,可使nt增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com