
| A. | 被氧化的砒霜为1.98mg | B. | 分解产生的氢气为0.672ml | ||
| C. | 转移的电子总数为0.18NA | D. | 和砒霜反应的锌为3.90mg |
分析 A.反应中As元素化合价由As2O3中+3价降低为AsH3中-3价,砒霜发生还原反应;
B.根据n=$\frac{m}{M}$计算As的物质的量,根据原子守恒进而计算生成氢气的物质的量,氢气所处的状态不一定是标准状况;
C.整个过程中,As元素化合价由As2O3中+3价降低为AsH3中-3价,AsH3中-3价升高为As中0价,据此计算转移电子数目;
D.电子转移守恒计算参加反应Zn的物质的量,再根据m=nM计算Zn的质量.
解答 解:A.反应中As元素化合价由As2O3中+3价降低为AsH3中-3价,砒霜发生还原反应,故A错误;
B.生成As的物质的量=$\frac{0.0015g}{75g•mo{l}^{-1}}$=2×10-5mol,根据原子守恒可知分解的AsH3为2×10-5mol,由H原子守恒可知生成氢气为$\frac{2×1{0}^{-5}mol×3}{2}$=3×10-5mol,故标况下,分解产生氢气体积为3×10-5mol×22.4L/mol=6.72×10-4L=0.672 mL,但氢气所处的状态不一定是标准状况,故其体积不一定是0.672 mL,故B错误;
C.整个过程中,As元素化合价由As2O3中+3价降低为AsH3中-3价,AsH3中-3价升高为As中0价,
故整个过程转移电子总数为2×10-5mol×(6+3)×NAmol-1=1.8×10-4NA,故C错误;
D.根据电子转移守恒,As2O3~2AsH3~12e-~6Zn,可知参加反应Zn的物质的量=2×10-5mol×6÷2=6×10-5mol,故参加反应Zn的质量=6×10-5mol×65g/mol=3.9×10-3g=3.9mg,故D正确;
故选D.
点评 本题考查根据方程式计算、氧化还原反应计算等,注意利用守恒思想进行的计算,B选项为易错点,学生容易忽略气体摩尔体积的使用条件.


科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫、氨、煤的液化均为物理变化 | |
| B. | 2CH3CH2OD+O2$→_{△}^{Cu}$2CH3CHO+2DHO | |
| C. | 甲醇、乙二醇、丙三醇都为饱和醇,熔沸点依次降低 | |
| D. | 已知常温下氢氧化镁的溶度积常数为a,则氢氧化镁悬浊液中:c(OH-)=$\root{3}{a}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电电池可以通过放电、充电实现化学能和电能的相互转化 | |
| B. | 放电时负极发生氧化反应,充电时该电极上有物质发生得电子的反应 | |
| C. | 现代技术使得电池设计比较先进,电池废弃后不必再进行无毒化处理 | |
| D. | 充电电池的化学反应原理是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:丁>丙>乙>甲 | |
| B. | 1mol A与足量B完全反应共转移了2mol电子 | |
| C. | 丙元素在周期表中的位置为第二周期第ⅣA族 | |
| D. | 甲、乙、丙、丁四种元素可以共同组成多种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
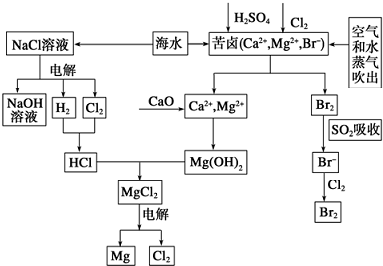
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | 深蓝色的[Cu(NH3)4]SO4溶液中加入乙醇析出晶体 | 乙醇增强了溶剂的极性 |
| B | 用KSCN检验溶液中的Fe3+ | Fe3+遇SCN-生成血红色沉淀 |
| C | CH4熔点低于CO2 | 碳氢键比碳氧键的键长短、键能大 |
| D | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com