

| 物质 | SiCl4 | SiHCl3 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | 33.0 | - | 315 |
| 升华温度/℃ | - | - | 180 | 300 |
分析 Ⅰ.根据反应Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0可知,该反应为放热反应,根据温度对平衡移动的影响答题;
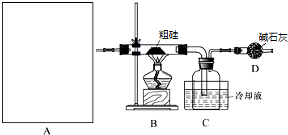
II.(1)根据题中制HCl的实验原理,为固体和液体加热,据此选择装置,反应中有剩余的氯化氢气体未反应,要吸收,同时SiHCl3易水解,要防止空气中的水分进入装置;
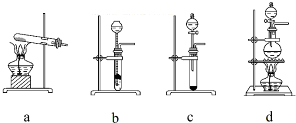
(2)液态粗品SiHCl3中含有杂质SiCl4、AlCl3、FeCl3等,根据这些物质的沸点不同,可选择分馏的方法进行除杂,根据分馏操作的装置可选择仪器;
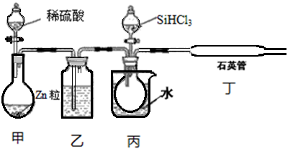
(3)用SiHCl3与H2反应制备纯硅,组装好仪器后,要先进行气密性检验,再在装置中通氢气,排尽空气后再进行SiHCl3与H2的反应,实验结束时还要继续通氢气,直到装置冷却,防止空气中的成分对反应干扰,根据装置可知,丙处是水浴,丁处进行SiHCl3与H2的反应,都要进行加热,实验尾气中有氯化氢等气体不能直接排到空气中,据此答题.
解答 解:Ⅰ.根据反应Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0可知,该反应为放热反应,升高温度,平衡移动会逆向移动,不利于SiHCl3的生成,所以选择温度较低的条件,即选a,
故答案为:a;因反应 Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0,温度较低时反应向正向进行程度较大,有利于SiHCl3的生成;
II.(1)根据题中制HCl的实验原理,为固体和液体加热,所以选择d装置,反应中有剩余的氯化氢气体未反应,要吸收,同时SiHCl3易水解,要防止空气中的水分进入装置,所以D中装碱石灰用来吸收剩余HCl、防止空气中的水蒸气进入C装置造成SiHCl3的水解,
故答案为:d;吸收剩余HCl;防止空气中的水蒸气进入C装置造成SiHCl3的水解;
(2)液态粗品SiHCl3中含有杂质SiCl4、AlCl3、FeCl3等,根据这些物质的沸点不同,可选择分馏的方法进行除杂,所以流程中操作①为分馏,根据分馏操作的装置可知,不是分馏操作所需的仪器是b d,
故答案为:分馏;b d;
(3)①用SiHCl3与H2反应制备纯硅,组装好仪器后,要先进行气密性检验,再在装置中通氢气,排尽空气后再进行SiHCl3与H2的反应,实验结束时还要继续通氢气,直到装置冷却,防止空气中的成分对反应干扰,所以实验步骤的顺序为dbacef,根据装置可知,丙处是水浴,丁处进行SiHCl3与H2的反应,都要进行加热,所以步骤c中需要加热的装置为丙、丁,
故答案为:dbacef;丙、丁;
②实验尾气中有氯化氢等气体不能直接排到空气中,而根据装置可知,装置中无尾气处理装置,
故答案为:无尾气处理装置.
点评 本题考查制备实验方案的设计,题目难度中等,综合了氯气的制法、硅的提纯、物质的分离提纯、对装置与操作的分析评价等实验知识,结合物质的性质明确原理为解答的关键,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:填空题
| 序号 | 各种化学变化 | 制备新物质或能量转化(主要) |
| 示例 | 实验室点燃酒精灯 | 化学能转变为热能 |
| 示例 | 利用氢气和氯气合成盐酸 | 制备新物质 |
| (1) | 从铜矿中提炼铜 | |
| (2) | 冬天,居民烧木炭取暖 | |
| (3) | 镁燃烧制照明弹 | |
| (4) | Pb+PbO2+2H2SO4$\frac{\underline{\;放电\;}}{\;}$2PbSO4+2H2O | |
| (5) | 6nH2O+6nCO2 $→_{叶绿素}^{光}$(C6H12O6)n+6nO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | HA 物质的量 | NaOH 物质的量 | 混合后溶 |
| 编号 | 浓度/(mol•L-1) | 浓度/(mol•L-1) | 液的 pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | N2 | H2 | NH3 |
| 起始(mol) | 2 | 7 | 0 |
| 10s(mol) | 1.6 | ||
| 平衡(mol) | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L KCl溶液 | B. | 自来水 | ||
| C. | 0.5mol/L盐酸 | D. | 0.5mol/L醋酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com