
��ѧ��Ӧԭ���ڿ��к�ũҵ�������й㷺Ӧ�á�
��1��ij��ѧ��ȤС����й�ҵ�ϳɰ���ģ���о�����Ӧ�ķ���ʽΪN2��g��+3H2��g�� 2NH3��g�� ��H<0����lL�ܱ������м���0.1 mol N2��0.3mol H2��ʵ��١��ڡ�����c��N2����ʱ�䣨t���ı仯����ͼ��ʾ��
2NH3��g�� ��H<0����lL�ܱ������м���0.1 mol N2��0.3mol H2��ʵ��١��ڡ�����c��N2����ʱ�䣨t���ı仯����ͼ��ʾ��
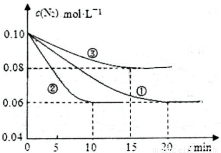
ʵ��ڴӳ�ʼ��ƽ��Ĺ����У��÷�Ӧ��ƽ����Ӧ����v��NH3��=_______________����ʵ�����ȣ�ʵ��ں�ʵ������ı��ʵ�������ֱ�Ϊ����ѡ�� �е�______________��_____________������ĸ��ţ���
�е�______________��_____________������ĸ��ţ���
A����ѹǿ B��Сѹǿ C�����¶� D�����¶� Eʹ�ô���
��2����֪NO2��N2O4�����ת����2NO2��g�� N2O4��g����
N2O4��g����
T��ʱ����0.40 mol NO2��������ݻ�Ϊ2L���ܱ������У��ﵽƽ����������c��N2O4��=0.05 mol/L����÷�Ӧ��ƽ�ⳣ��K=_______________��
 ״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �⻯��Ӧ | B�� | ����ˮ�ⷴӦ | C�� | �ӳɷ�Ӧ | D�� | ������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�߶���10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��ӦX+Y�TM+NΪ���ȷ�Ӧ���Ը÷�Ӧ��˵����ȷ��( )
A��X������һ������M
B��Y������һ������N
C��X��Y��������һ������M��N��������
D����Ϊ�÷�ӦΪ���ȷ�Ӧ���ʲ��ؼ��ȾͿɷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�߶����¿�һ��ѧ�Ծ��������棩 ���ͣ�ѡ����
ͬ��ͬѹ�£����и����Ȼ�ѧ����ʽ�У���H1����H2��
A��C��s����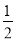 O2��g����CO��g������H1 C��s����O2��g����CO2��g������H2
O2��g����CO��g������H1 C��s����O2��g����CO2��g������H2
B��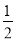 H2��g����
H2��g����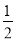 Cl2��g����HCl��g������H1 H2��g����Cl2��g����2HCl��g������H2
Cl2��g����HCl��g������H1 H2��g����Cl2��g����2HCl��g������H2
C��2H2��g����O2��g����2H2O��g������H1 2H2��g����O2��g����2H2O��l������H2
D��S��g����O2��g����SO2��g������H1 S��s����O2��g����SO2��g������H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶����¿�һ��ѧ���������棩 ���ͣ�������
����������ȼ�գ������������ֹ�̬�����6.2 g�ĵ����ף�P����6.4 g������ȼ�գ�����Ӧ��ľ������ų�a kJ������
��1 ��ͨ������ȷ����Ӧ�������ɣ��û�ѧʽ��ʾ���� ������Ӧ��������g��Ϊ ��
��ͨ������ȷ����Ӧ�������ɣ��û�ѧʽ��ʾ���� ������Ӧ��������g��Ϊ ��
��2����֪������ȼ����Ϊb kJ/mol����1mol P��O2��Ӧ���ɹ�̬P2O3�ķ�Ӧ�Ȧ�H�� ��
��3��д��1mol P��O2��Ӧ���ɹ�̬P2O3���Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶����¿�һ��ѧ���������棩 ���ͣ�ѡ����
��ӦCO��g����2H2��g��  CH3OH��g�������е������仯�������ͼ��ʾ�����ߢ�����ߢ�ֱ��ʾ��ʹ�ô�����ʹ�ô�������������������ж���ȷ����
CH3OH��g�������е������仯�������ͼ��ʾ�����ߢ�����ߢ�ֱ��ʾ��ʹ�ô�����ʹ�ô�������������������ж���ȷ����

A���÷�Ӧ�Ħ�H����91 kJ/mol B������������÷�Ӧ�Ħ�H��С
C����Ӧ�������������������������� D������÷�Ӧ����Һ̬CH3OH����H���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
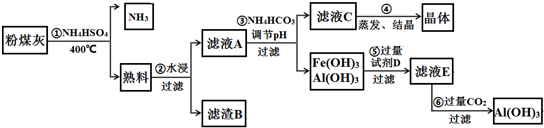
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | O |
| 2 | �� | �� | ||||||
| 3 | �� | �� | �� | �� | �� | |||
| 4 | �� | �� | �� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com