
| 选项 | A | B | C | D |
| 甲 | 物质 | 构成物质微粒 | 金属元素 | 化学反应 |
| 乙、丙 | 混合物、纯净物 | 分子、原子、离子 | 铜、碳、氖 | 化合反应 分解反应 |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
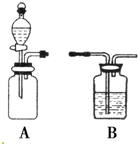 如图是中学化学中常见的实验装置.
如图是中学化学中常见的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4溶液、FeCl3溶液 | B. | 溴水、KMnO4溶液 | ||
| C. | NaOH溶液、FeCl3溶液 | D. | 溴水、Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 析出的氢氧化钠的质量为大于$\frac{40a}{31}$g | |
| B. | 单位体积溶液中OH-个数不变 | |
| C. | 溶液中Na+数目减少 | |
| D. | 氧化钠与水反应生成了碱,所以溶质的质量分数变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
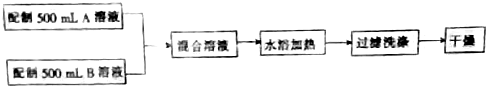
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
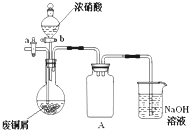 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA是弱酸 | B. | HA的电离方程式为HA═H++A- | ||
| C. | 该溶液中c(HA)+c(A-)=0.1 mol•L-l | D. | NaA溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大 | |
| B. | 甲烧杯中的酸过量 | |
| C. | 两烧杯中参加反应的锌等量 | |
| D. | 反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com