
下列说法正确的是()
A. 32gO2占有的体积约为22.4L
B. a L甲烷和乙烷混合气体中的分子数约为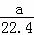 ×6.02×1023
×6.02×1023
C. 在标准状况下,22.4L水的质量约为18g
D. 22g二氧化碳与标准状况下的11.2L HCl含有相同的分子数
考点: 气体摩尔体积.
专题: 阿伏加德罗常数和阿伏加德罗定律.
分析: A.氧气所处的状态不一定是标准状况,气体摩尔体积不一定是22.4L/mol;
B.混合气体所处的状态不一定是标准状况,气体摩尔体积不一定是22.4L/mol;
C.标况下水为液态,不能用气体摩尔体积计算其物质的量;
D.根据n=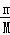 =
= 计算二氧化碳、HCl物质的量,再由N=nNA判断.
计算二氧化碳、HCl物质的量,再由N=nNA判断.
解答: 解:A.32gO2的物质的量为1mol,氧气所处的状态不一定是标准状况,气体摩尔体积不一定是22.4L/mol,所占用的体积不一定是22.4L,故A错误;
B.混合气体所处的状态不一定是标准状况,气体摩尔体积不一定是22.4L/mol,a L甲烷和乙烷混合气体中的物质的量不一定是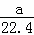 mol,故B错误;
mol,故B错误;
C.标况下水为液态,不能用气体摩尔体积计算其物质的量,22.4L水的质量远远大于18g,故C错误;
D.22g二氧化碳的物质的量=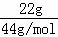 =0.5mol,标准状况下的11.2L HCl的物质的量=
=0.5mol,标准状况下的11.2L HCl的物质的量= =0.5mol,二者物质的量相等,由N=nNA可知,二者含有分子数目相等,故D正确,
=0.5mol,二者物质的量相等,由N=nNA可知,二者含有分子数目相等,故D正确,
故选D.
点评: 本题考查气体摩尔体积,难度不大,注意气体摩尔体积的使用条件及对象.


科目:高中化学 来源: 题型:
分离苯和苯酚的混合物,通常采用的方法是( )
|
| A. | 加水振荡后,用分液漏斗分离 |
|
| B. | 加稀盐酸振荡后,用分液漏斗分离 |
|
| C. | 加入浓溴水振荡后过滤 |
|
| D. | 加NaOH溶液振荡后,用分液漏斗分离,取下层液体通入CO2或加入适量盐酸后,再用分液漏斗分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
重铬酸钠二水合物Na2Cr2O7·2H2O广泛用作氧化剂、金属表面精整、皮革制作等。以铬矿石(Cr2O3,含FeO、Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程如下:
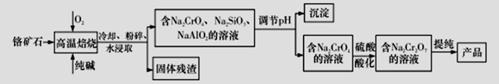
请回答下列问题:
(1)写出Cr2O3在高温焙烧生成Na2CrO4的化学方程式__________________________。
(2)调节pH后得到的沉淀主要是____________(填写化学式).
(3)写出用硫酸酸化使Na2CrO4转化为Na2Cr2O7的原理(写出离子方程式并加以文字说明):__________。
(4)氯化铬酸CrO2Cl2是红色液体,它可由Na2Cr2O7与NaCl的固体混合物和浓硫酸小心加热下制得,写出制备CrO2Cl2的化学反应方程式____________________________。
(5)某化工厂采用石墨作电极电解Na2CrO4溶液,实现Na2CrO4转化为Na2Cr2O7的生产,其原理如图所示。

①通电后阳极区溶液的颜色变化为__________________________________。
②写出电解Na2CrO4溶液制备Na2Cr2O7的化学反应方程式:_______________________________。
③在电流为I A.通电时间为t s后,两极共收集到3.36 L气体(标准状况下),则阿伏加德罗常数的表达式NA =_____mol-1(己知电子的电量为1.6* 10-19C)。
(6)Na2Cr2O7可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被氧化所需要的O2的质量,单位:mg·L-1),现有某水样200.00 mL,酸化后加入c1 mol/L的Na2Cr2O7溶液V1 mL,使水中的还原性物质完全被氧化(还原产物为Cr3+ );再用c2 mol/L的FeSO4溶液滴定剩余的Cr2O72-,结果消耗FeSO4溶液V2 mL。则该水样的COD为_____________mg·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
.短周期元素W 、X、 Y、 Z的原子序数依次增大,且W 、X、 Y+、 Z的最外层电子数与其电子层数的比值依次为2 、3、 4、 2(不考虑零族元素)。下列关于这些元素的叙述错误的是 ( )
A.X和其他三种元素均可形成至少2种二元化合物
B.W和X、Z两种元素分别形成的二元化合物中,均有直线形分子
C.W 、X和Y三种元素可以形成碱性化合物
D.Z和其他三种元素形成的二元化合物,其水溶液均呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的分离方法不正确的是()
A. 用过滤的方法除去食盐水中的泥沙
B. 用蒸馏的方法将自来水制成蒸馏水
C. 用酒精萃取碘水中的碘
D. 用淘洗的方法从沙里淘金
查看答案和解析>>
科目:高中化学 来源: 题型:
分离四氯化碳和甲苯的混合物(两者互溶,沸点分别为76.75℃和110.6℃),可选用的分离方法为()
A. 萃取法 B. 蒸馏法 C. 结晶法 D. 分液法
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是()
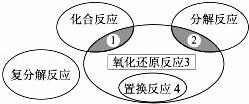
A. 2H2+O2 2H2O
2H2O
B. 2NaHCO3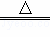 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C. CuO+CO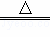 Cu+CO2
Cu+CO2
D. Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
根据以下反应判断:Fe3+、Fe2+、Cu2+的氧化性强弱顺序是()
①Fe+CuCl2=Cu+FeCl2
②2FeCl3+Cu=CuCl2+2FeCl2.
A. Fe2+>Cu2+>Fe3+ B. Fe3+>Fe2+>Cu2+
C. Fe3+>Cu2+>Fe2+ D. Cu2+>Fe2+>Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com