
【题目】在铜锌原电池中(如下图),
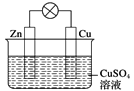
以硫酸铜为电解质溶液,锌为________极,电极上发生的是________(填“氧化”或“还原”)反应,电极反应式为_______________________________。锌片上观察到的现象为_______;
铜为________极,电极上发生的是________(填“氧化”或“还原”)反应,电极反应式是____;
铜片上观察到的现象是_______________,原电池总反应的离子方程式为_______。
【答案】负 氧化 Zn-2e-===Zn2+ 锌片溶解 正 还原 Cu2++2e-===Cu 铜极变粗 Zn+Cu2+===Zn2++Cu
【解析】
根据金属活泼性,锌比铜活泼,锌作负极,铜作正极;由铜、锌和硫酸铜组成的原电池中,锌作负极失电子生成锌离子,铜作正极,溶液中铜离子得到电子生成铜。
在铜锌原电池中,以CuSO4为电解质溶液,锌比铜活泼失电子为负极,电极上发生的是氧化反应,电极反应式为Zn -2e- =Zn2+,锌片上观察到的现象为锌片逐渐溶解,铜为正极,得电子,电极上发生的是还原反应,电极反应成为Cu2++2e-===Cu,铜片上观察到的现象是铜极变粗,原电池反应的离子方程式为Zn+Cu2+===Zn2++Cu。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】如图所示,若电解5min时,测得铜电极的质量增加2.16g,试回答:
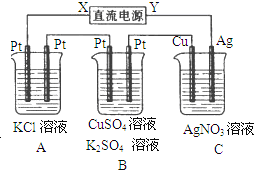
(1)电源中X电极是______(填“正”或“负”)极。
(2)通电5min,时,B中收集到224mL(标准状况下)气体,溶液体积为200mL,(电解前后溶液的体积变化忽略不计)则通电前c(CuSO4)=______。
(3)若A中KCl溶液的体积也是200mL,则电解后溶液的pH=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究铁与氯气的反应,某同学甲设计了如下的实验方案。其实验装置为:
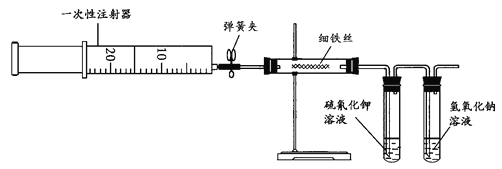
其实验步骤为:
(1)用注射器吸取20 mL左右的氯气。
(2)在硬质玻璃管内加入一定量的细铁丝,一支试管内加入硫氰化钾溶液,另一支试管中加入氢氧化钠溶液。按图所示连接实验装置,并固定在铁架台上。经检验装置不漏气。
(3)加热硬质玻璃管内铁丝约1 min,然后把注射器中的氯气注入到硬质玻璃管内,观察实验现象。可观察到的主要现象是____________, ____________。
(4)氢氧化钠溶液的作用是_____________。
(5)某同学将一小块生锈的铁片完全溶于适量的盐酸,对所得溶液中是含有Fe2+还是含有Fe3+,同学们提出不同看法。有一位同学提出:可能只有Fe2+而无Fe3+。你认为他的猜想可能吗?_________ 。请自选药品设计实验验证他的猜想(写出操作、现象和结论)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3X(g)+Y(g) 2Z(g)+2W(g)在2 L密闭容器中进行,5 min时Y减少了0.5 mol,0~5 min内此反应的平均速率为
A.v(X)=0.05 mol·L1·min1
B.v(Y)=0.10 mol·L1·min1
C.v(Z)=0.10 mol·L1·min1
D.v(W)=0.05 mol·L1·s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下在一容积恒为2L的容器内发生反应:2A(g)+B(g)![]() 2C(g),已知起始投入4molA(g) 和2 mol B(g),经2 s后测得C的浓度为0.6 mol/L,并且2 s后各组分浓度不再改变。下列说法正确的是
2C(g),已知起始投入4molA(g) 和2 mol B(g),经2 s后测得C的浓度为0.6 mol/L,并且2 s后各组分浓度不再改变。下列说法正确的是
A.2 s内用物质A表示的平均反应速率为0.6 mol/(Ls)
B.2 s内用物质B表示的平均反应速率为0.6 mol/(Ls)
C.2 s后每有0.6 mol的物质B生成,同时就有0.6 mol物质C生成
D.2 s时物质B的浓度为0.7 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2O2与CO2、H2O反应的叙述正确的是( )
A.Na2O2与H2O反应中,Na2O2作氧化剂,H2O作还原剂
B.Na2O2与CO2反应中,Na2O2作还原剂,CO2作氧化剂
C.Na2O2与CO2反应中,1molNa2O2转移2mol电子
D.Na2O2与水反应中,1molNa2O2转移1mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍广泛应用于电镀、电池、催化剂等工业。某科研小组以粗硫酸镍(含Cu2+、Fe3+、Ca2+、Mg2+、Zn2+等)为原料,经如图一系列除杂过程模拟精制硫酸镍工艺。回答下列问题。
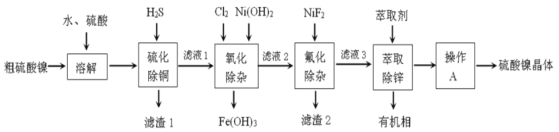
(1)滤渣1的主要成分是__(写化学式),写出“硫化除铜”过程中发生的氧化还原反应的离子方程式___。
(2)“氧化除杂”时加入Cl2和Ni(OH)2的作用分别是___。
(3)已知25℃时,Ksp[CaF2]=3.95×10-11;Ksp[MgF2]=6.40×10-9。则“氟化除杂”过后滤液3中 =__。(保留三位有效数字)
=__。(保留三位有效数字)
(4)“萃取”时使用萃取剂R在硫酸盐中对某些金属离子的萃取率与溶液pH的关系如图。则实验时需控制的pH适宜范围是___(填字母序号)。

A.1~2 B.3~4 C.4~5 D.5~6
(5)将萃取后所得富含硫酸镍的溶液经操作A可得硫酸镍晶体,则操作A为___、___、过滤、洗涤等。
(6)称取2.000g硫酸镍晶体(NiSO4·6H2O)样品溶解,定容至250mL。取25.00mL试液,用0.0200mol·L-1的EDTA(Na2H2Y)标准溶液滴定至终点。重复实验,平均消耗EDTA标准溶液体积为36.50mL。反应为Ni2++H2Y2-=NiY2-+2H+。计算样品纯度为__%。(保留三位有效数字,且不考虑杂质反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )

A.E处棉花球变成黄色,说明Cl2的氧化性比Br2强
B.F处棉花球变成蓝色,说明Br2的氧化性比I2强
C.E处发生反应的离子方程式为:Cl2+2Br-===2Cl-+Br2
D.G装置中NaOH溶液与Cl2反应的离子方程式为:2OH-+Cl2===ClO-+Cl-+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com