
500 mL某溶液中除H+和OH-外,只含有4.5 mol SO42-和3.0 mol金属离子,则该溶液溶质的物质的量浓度为( )
A.6.0 mol·L-1
B.3.0 mol·L-1
C.9.0 mol·L-1
D.4.5 mol·L-1
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
有M、N两种溶液, 经测定这两种溶液中含有下列12种离子:Al3+、Cl-、Na+、K+、NO
经测定这两种溶液中含有下列12种离子:Al3+、Cl-、Na+、K+、NO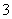 、OH-、Fe2+、[Al(OH)4]-、CO
、OH-、Fe2+、[Al(OH)4]-、CO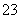 、NH
、NH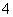 、SO
、SO 、H+。
、H+。
(1)完成下列表格中实验①的结论和实验②的实验内容以及现象:
| 实验内容以及现象 | 结论 |
| ①取少量N溶液滴加足量的硝酸钡溶液,无沉淀产生 | |
| ② | 确定M溶液中含有Na+,不含K+ |
|
|
(2)根据(1)中的实验回答:
NO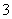 存在于________溶液中,理由是_______________________________________;
存在于________溶液中,理由是_______________________________________;
Cl-存在于________溶液中,理由是________________________________________。
(3)根据(1)中的实验确定,M溶液中含有的离子为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子组在一定条件下不能大量共存,且所给离子方程式能说明不能共存原因的是( )
| 选项 | 条件 | 离子组 | 共存所发生的离子反应方程式 |
| A | pH=1的溶液 | Fe2+、Al3+、Cl-、MnO4- | 10Cl-+2MnO4-+16H+===2Mn2++5Cl2↑+8H2O |
| B | 常温下c(OH)-=10-2mol·L-1的能与金属铝反应放出氢气的溶液 | K+、NO3-、Cl-、NH4+ | NH4++OH-===NH3·H2O |
| C | 能使酚酞试液变红的溶液 | Na+、Cl-、S2-、SO32- | SO32-+2S2-+6H+===3S↓+3H2O |
| D | 含有大量H+的透明溶液 | Na+、Cu2+、AlO2-、SiO32- | 2H++SiO32-===H2SiO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA 为阿伏加德罗常数的值。下列说法正确的是( )
A.1 L 1 mol·L-1的NaClO 溶液中含有ClO-的数目为NA
B.78 g 苯含有C=C 双键的数目为3NA
C.常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA
D.标准状况下,6. 72 L NO2与水充分反应转移的电子数目为0. 1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
依据下列条件能将某溶液的物质的量浓度计算出来的是( )
①每10 mL溶液中含有0.23 g Na+的硫酸钠溶液
②每10个水分子中溶有1个Na+的NaOH溶液
③浓度为18.4 mol·L-1的硫酸10 mL加到100 mL水中所得的稀硫酸
④标准状况下,100 mL氨气溶于20 mL水中所得溶液的密度为0.9 g·cm-3的氨水
A.①② B.①③
C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
大气中CO2的含量增多会引起“温室效应”,你认为造成大气中CO2含量增多的主要原因是( )
A.植物的呼吸与腐烂放出CO2
B.人类和动物呼吸放出CO2
C.工业上大量燃烧含C燃料
D.建筑工业的发展使大量碳酸盐分解
查看答案和解析>>
科目:高中化学 来源: 题型:
某固体物质A受热分解,生成B、C、D三种物质。B是一种钾盐,向B的水溶液中加入澄清石灰水,产生白色沉淀E;E溶于盐酸放出无色无味气体D;将D通入澄清石灰水中,先出现浑浊现象,然后又变澄清;C在常温下是一种无色液体。
(1)写出A、B、E的化学式。
A________,B________,E________。
(2)写出反应的化学方程式。
①A受热分解:______________________________________________________;
②将D通入澄清石灰水中,先出现浑浊现象,然后又变澄清:
________________________________________________________________________。
(3)写出反应的离子方程式。
①向B的水溶液中加入澄清石灰水,产生白色沉淀E:
_____________________________________________________________________;
②E溶于盐酸放出无色无味的气体D:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F、G为原子序数依次递增的7种短周期主族元素。A、B元素的最高正价与最低负价的代数和均为零;C元素是植物生长三大营养元素之一;D的单质具有强氧化性,其氢化物能和一种半导体材料反应生成常温常压下的两种气体;E原子核外K层电子数与M层电子数相等;F原子的价电子数等于电子层数的两倍。请回答下列问题:
(1)CD3 的电子式为 ;
(2)用离子方程式表示G 的非金属性比F强 ;
(3)EF在空气中充分灼烧生成一种稳定性的盐,则此反应方程式为 ;
(4)C的氢化物与G的单质以物质的量之比1:3反应,生成二元化合物X和一种气体,该气体遇氨气产生“白烟”,则X的化学是为 ,X与水反应的产物名称是
;
(5)已知充分燃烧一定量的B2A2放出Q kJ的能量,燃烧生成的产物恰好与100ml 5 mol·L-1的NaOH溶液完全反应生成正盐,则燃烧1mol B2A2放出的热量为 KJ;
(6)常温下,E(OH)2在水中的沉淀溶解平衡曲线如图所示(单位mol·L-1)。要使c(E2+) 为0.001 mol·L-1的溶液形成沉淀,则溶液的PH值至少升高到 。


查看答案和解析>>
科目:高中化学 来源: 题型:
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如右图。据图分析,下列判断不正确的是
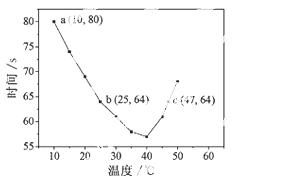
A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中b、c两点对应的NaHSO3反应速率相等
C.图中a点对应的NaH SO3反应速率为5.0 ×10-5mol·L-1·s-1
SO3反应速率为5.0 ×10-5mol·L-1·s-1
D.温度高于40℃时,淀粉不宜用作该试验的指示剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com