
| A. | 保存在水中 | B. | 密封,保存在广口瓶中 | ||
| C. | 用铝箔包裹,密封在广口瓶中 | D. | 密封,保存在煤油中 |
分析 钠是活泼的金属,易和水、氧气反应,钠的密度大于煤油的密度,所以要保存钠应该隔绝空气和水蒸气,据此分析解答.
解答 解:A.钠和水反应生成氢氧化钠和氢气,所以钠不能保存在水中,故A错误;
B.钠和空气中氧气和水蒸气都反应,所以不能保存在广口瓶中,故B错误;
C.钠容易和氧气发生缓慢氧化生成Na2O,Na2O吸收空气中的水分生成NaOH,NaOH又具有吸湿性,反应生成的NaOH表面潮解会变成NaOH溶液,NaOH溶液会与铝箔发生反应,故C错误;
D.钠的密度小于煤油的密度,且和煤油不反应,所以钠可以保存在煤油中而隔绝空气和水,故D正确;
故选D.
点评 本题以钠的储存方法的选择为载体考查了钠的物理、化学性质,难度不大,可以根据金属的性质选择相应的储存方法.


科目:高中化学 来源: 题型:选择题
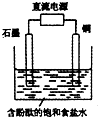
| A. | 铜电极上发生还原反应 | B. | 石墨电极附近溶液呈红色 | ||
| C. | 溶液中的Na+向石墨电极移动 | D. | 铜电极附近观察到黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 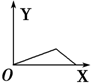 | B. | 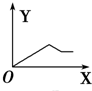 | C. | 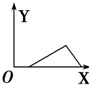 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱电解质一定是共价化合物 | |
| B. | 氨气溶于水,当c(OH-)=c(NH4+)时,表明NH3•H2O电离处于平衡状态 | |
| C. | 强电解质溶液中不存在溶质分子,弱电解质溶液中存在溶质分子 | |
| D. | 由0.1 mol•L-1一元碱BOH的pH=10,可知溶液中存在BOH═B++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
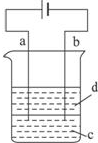 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
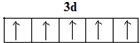 .
.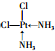 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Fe3+、NO3-、K+ | B. | Al3+、Na+、Cl-、SO42- | ||
| C. | Na+、Ba2+、NO3-、Cl- | D. | K+、Na+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
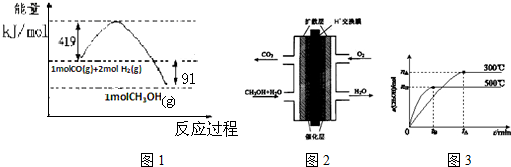
| 化学键 | H-H | H-O | O=O |
| 键能KJ/mol | 436 | x | 496 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将盐卤或石膏加入豆浆中制豆腐 | |
| B. | 钢笔同时使用两种不同牌号的蓝黑墨水,易出现堵塞 | |
| C. | 向氯化铁溶液中加入氢氧化钠溶液出现红褐色沉淀 | |
| D. | 在河水与海水的交界处,易形成三角洲 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com