
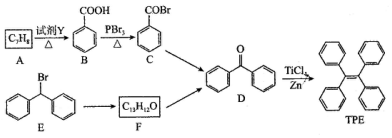
 .
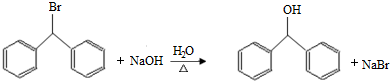
. )的一元取代物;②存在羟甲基(-CH2OH).写出W所有可能的结构简式
)的一元取代物;②存在羟甲基(-CH2OH).写出W所有可能的结构简式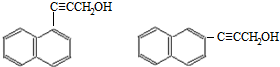 .
.分析 (1)由A的分子式与B的结构可知,应是甲苯被酸性高锰酸钾溶液氧化生成苯甲酸;
(2)对比B、C的结构简式可知,B发生取代反应生成C;由B、D结构可知,含有的官能团分别为羧基、羰基;
(3)E的分子式为C13H11Br,F的分子式为C13H12O,对比E的结构与F的分子式可知,E中Br原子被-OH取代生成F;
(4)D的分子式为C13H10O,不饱和度为9,W是D的同分异构体属于萘(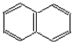 )的一元取代物,存在羟甲基(-CH2OH),萘环不饱和度为7,则侧链存在碳碳三键,故侧链为-C≡CCH2OH,萘有2种化学环境不同的H原子,据此书写;
)的一元取代物,存在羟甲基(-CH2OH),萘环不饱和度为7,则侧链存在碳碳三键,故侧链为-C≡CCH2OH,萘有2种化学环境不同的H原子,据此书写;
(5)a.羧基酸性大于酚羟基;
b.D含有苯环与羰基,能与氢气发生加成反应;
c.E中含有4种化学环境不同的H原子;
d.TPE只有含有C、H2种元素,属于烃,含有苯环,属于芳香烃,含有碳碳双键,属于烯烃.
解答 解:(1)由A的分子式与B的结构可知,应是甲苯被酸性高锰酸钾溶液氧化生成苯甲酸,
故答案为:甲苯;
(2)对比B、C的结构简式可知,B发生取代反应生成C;由D结构可知,含有的官能团分别为羰基,
故答案为:取代反应;羰基;
(3)对比E的结构与F的分子式可知,E中Br原子被-OH取代生成F,反应方程式为 ,
,
故答案为: ;
;
(4)D的分子式为C13H10O,不饱和度为9,W是D的同分异构体属于萘( )的一元取代物,存在羟甲基(-CH2OH),萘环不饱和度为7,则侧链存在碳碳三键,故侧链为-C≡CCH2OH,萘有2种化学环境不同的H原子,符合条件的W有:
)的一元取代物,存在羟甲基(-CH2OH),萘环不饱和度为7,则侧链存在碳碳三键,故侧链为-C≡CCH2OH,萘有2种化学环境不同的H原子,符合条件的W有: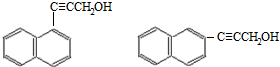 ,
,
故答案为: ;
;
(5)a.羧基酸性大于酚羟基,故a正确;
b.D含有苯环与羰基,能与氢气发生加成反应,属于还原反应,故b错误;
c.E中含有4种化学环境不同的H原子,故c错误;
d.TPE只有含有C、H2种元素,属于烃,含有苯环,属于芳香烃,含有碳碳双键,属于烯烃,故d正确,
故选:ad.
点评 本题考查有机物的合成,注意根据有机物的结构与分子式进行分析解答,是对有机化学基础的综合考查,难度不大.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 有关物质的转化关系如图所示,固体X由两种常见元素组成,其中一种为常见金属元素,另一种为非金属元素,且质量比为14:1,B是常见的无色无味气体,可以使澄清石灰水变浑浊,C是一种红棕色气体,D是最常见的无色液体,E溶液遇硫氰化钾溶液显血红色,F是紫红色的金属单质,I是常见的无色气体,遇空气变为红棕色.
有关物质的转化关系如图所示,固体X由两种常见元素组成,其中一种为常见金属元素,另一种为非金属元素,且质量比为14:1,B是常见的无色无味气体,可以使澄清石灰水变浑浊,C是一种红棕色气体,D是最常见的无色液体,E溶液遇硫氰化钾溶液显血红色,F是紫红色的金属单质,I是常见的无色气体,遇空气变为红棕色. 
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:2 | C. | 4:1 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 | |
| B. | 验证溶液中是否含有Cl-,加稀硝酸酸化的AgNO3溶液,有白色沉淀,证明含Cl- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| D. | 某溶液中滴加盐酸酸化的BaCl2溶液,生成白色沉淀,证明一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
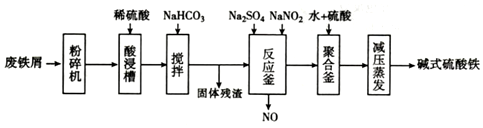
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6g金属钠与足量O2充分反应后,所得固体中阴、阳离子的总数为0.3NA | |
| B. | 1L 0.5 mol/L的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目小于0.5NA | |
| C. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| D. | 1L含NA个Al3+的Al(NO3)3液中,NO3-物质的量浓度为3 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com