
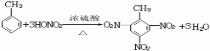
 ,此反应属于取代反应,其生成物的名称是2.4.6-三硝基甲苯
,此反应属于取代反应,其生成物的名称是2.4.6-三硝基甲苯分析 该烃的相对分子质量=46×2=92,由于该烃不能使溴水褪色,可使高锰酸钾酸性溶液褪色,所以它应当是苯的同系物而不是烯烃,根据苯同系物通式CaH2a-6得12a+2a-6=92,解得a=7,即x=7,y=8,则分子式为C7H8,应为甲苯,可与浓硝酸在浓硫酸作用下生成三硝基甲苯.
解答 解:该烃的相对分子质量=46×2=92,由于该烃不能使溴水褪色,可使高锰酸钾酸性溶液褪色,所以它应当是苯的同系物而不是烯烃,根据苯同系物通式CaH2a-6得12a+2a-6=92,解得a=7,即x=7,y=8,则分子式为C7H8,应为甲苯,
①由以上分析可知x=7,y=8,18.4g此烃能跟0.6mol H2发生加成反应,n(C7H8)=$\frac{18.4g}{92g/mol}$=0.2mol,即1mol有机物与3mol氢气发生加成反应,生成相应的饱和烃CxHz.应生成环烷烃,为C7H14,
故答案为:7、8、14;
②甲苯可与浓硝酸在浓硫酸作用下发生取代反应生成2.4.6-三硝基甲苯,反应的方程式为 ,
,
故答案为: ;取代反应;2.4.6-三硝基甲苯;
;取代反应;2.4.6-三硝基甲苯;
③苯与硝酸反应生成硝基苯,而甲苯与硝酸反应生成2.4.6-三硝基甲苯,说明有机物中基团之间相互影响,甲苯中苯环上的氢原子变得活泼,
故答案为:有机物中基团之间相互影响,甲苯中苯环上的氢原子变得活泼.
点评 本题考查有机物的推断,题目难度不大,注意首先用相对密度求出该烃的相对分子质量,然后依据它的性质判断它所属的类别,最后确定分子式.


科目:高中化学 来源: 题型:解答题
 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$
 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ (苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:
(苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:
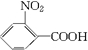 .
.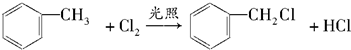 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧的摩尔质量为32 g/mol | |
| B. | 1 mol CO32-的质量为60 g/mol | |
| C. | H2SO4的摩尔质量等于H2SO4的相对分子质量 | |
| D. | 1 mol CO2的质量与CO2的相对分子质量在数值上相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验课上配制500mL 0.5mol/L的NaOH溶液,试回答下列问题.
实验课上配制500mL 0.5mol/L的NaOH溶液,试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成了氢氧化铁沉淀 | |
| B. | 体系中存在着氢氧化铁的沉淀溶解平衡 | |
| C. | 溶液中不再存在Fe3+ | |
| D. | 加入少量盐酸,则溶液中Fe3+浓度会上升 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com