
| A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42? |
| C、加入盐酸无现象,再加氯化钡溶液有白色沉淀生成,原溶液一定有硫酸根离子 |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
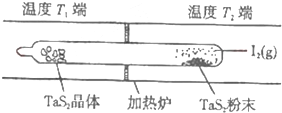 (1)等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB?cC(s)+dD.当反应进行一段时间后,测得A减少了n mol,B减少了
(1)等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB?cC(s)+dD.当反应进行一段时间后,测得A减少了n mol,B减少了| n |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
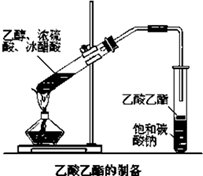 实验室用图所示装置来制取乙酸乙酯,回答下列问题:
实验室用图所示装置来制取乙酸乙酯,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试剂或方法 | 化学方程式 | |
| Mg(Al) | ||
| CO(CO2) | ||
| Na2CO3粉未 (NaHCO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某有机物的结构简式如图,关于该物质的下列说法:①能和溴水发生取代反应 ②能发生消去反应 ③能发生氧化反应 ④能发生加成反应 ⑤能发生水解反应,其中不正确的是( )
某有机物的结构简式如图,关于该物质的下列说法:①能和溴水发生取代反应 ②能发生消去反应 ③能发生氧化反应 ④能发生加成反应 ⑤能发生水解反应,其中不正确的是( )| A、①③ | B、②⑤ | C、②③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、利用Cu(OH)2替代CuO也可调试溶液pH不影响实验结果 |
| B、若要用实验测定所得硫酸铜晶体中结晶水的数目要用到坩埚和坩埚钳 |
| C、洗涤晶体:向滤出晶体的漏斗中加少量水浸没晶体,自然流下,重复2-3次 |
| D、用18mol/L浓硫酸配制溶解所用4mol/L的稀硫酸,玻璃仪器一般只有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ka=-Kh |
| B、Ka=Kh-1 |
| C、Ka?Kh=Kw |
| D、Ka?Kw=Kh |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25°时,在pH=0的溶液中,NO3-、SO42-、I-、K+可以大量共存 |
| B、物质的量浓度相等的Na2CO3和NaHCO3溶液,其25°时,pH是pH(Na2CO3)<pH(NaHCO3) |
| C、FeBr2溶液中通入少量Cl2时,离子方程式为2Br-+Cl2═2Cl-+Br2 |
| D、醋酸与NaOH发生中和反应时,当c(CH3COO-)=c(Na+)时,c(H+)=c(OH?) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com