
科目:高中化学 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:选择题
下列叙述正确的是
A.pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4
B.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
C.液氯虽然不导电, 但溶解于水后导电情况良好,因此,液氯也是强电解质
但溶解于水后导电情况良好,因此,液氯也是强电解质
D. 溶液中c(H+)越大,pH也越大,溶液的酸性就越强
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省杭州市五县七校高二上期中化学试卷(解析版) 题型:实验题
氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与NaOH溶液反应)中 AlN的含量,某实验小组设计了如下两种实验方案。已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。

(1)上图C装置中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,首先检查装置的气密性,再加入实验药品。接下来的实验操作是 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是 。
(3)由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见 。
【方案2】按以下步骤测定样品中A1N的纯度:
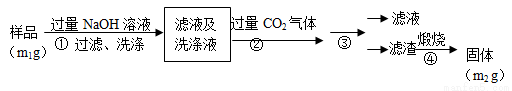
(4)步骤②生成沉淀的离子方程式为_________________。
(5)步骤③的操作是 。A1N的纯度是 (用m1、m2表示)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省杭州市五县七校高二上期中化学试卷(解析版) 题型:选择题
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn+2MnO2+H2O==Zn(OH)2+Mn2O3。下列说法正确的是
A.电池工作时,锌失去电子,发生还原反应
B.电池工作时,电子由正极通过外电路流向负极
C.电池正极的电极反应式为:2MnO2+H2O+2e— == Mn2O3+2OH—
D.当锌的质量理论上减小6.5g时,溶液中通过0.2mol电子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省杭州市五县七校高二上期中化学试卷(解析版) 题型:选择题
下列反应最终能生成含三价铁的化合物的是
①过量Fe与HNO3 ② 铁丝在硫蒸汽中燃烧 ③过量的Fe在Cl2中燃烧
④铁与CuCl2溶液反应 ⑤Fe(OH)2露置于空气中
A.①②③ B.①③⑤ C.③④ D.③⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省济宁市历城区高二上期中化学试卷(解析版) 题型:填空题
联合国气候变化大会于2009年12月7~18日在哥本哈根召开。中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%。
(1)有效“减碳”的手段之一是节能,下列制氢方法最符合这一做法的是_________(填序号)。
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O CO+3H2
CO+3H2
(2)用CO2和氢气合成CH3OCH3(甲 醚 )是解决能源危机的研究方向之一。
已知:CO(g)+2H2(g)= CH3OH(g) △H = Q1kJ·mol-1
2CH3OH(g)= CH3OCH3(g)+H2O(g) △H = Q2kJ·mol-1
CO(g)+H2O(g)= CO2(g)+H2(g) △H = Q3kJ·mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为:____________________。
(3)在催化剂和一定温度、压强条件下,CO与H2可反应生成甲醇:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:p1__________p2 (填“>”、“<”或“ = ”, 下同),该反应的△H__________
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:p1__________p2 (填“>”、“<”或“ = ”, 下同),该反应的△H__________ 0 。
0 。

查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省济宁市历城区高二上期中化学试卷(解析版) 题型:选择题
将4molA气体和2molB气体在2 L的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)  2C(g)。若经2 s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
2C(g)。若经2 s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1 ;
②用物质B表示的反应的平均速率为0.6 mol·L -1·s-1;
-1·s-1;
③2s时物质A的转化率为30% ;
④2s时物质B的浓度为1.4mol·L-1。
其中正确的是( )
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省天门市三校高一上学期期中化学试卷(解析版) 题型:选择题
已知常温下在溶液里可发生如下两个离子反应:
Ce4++Fe2+===Fe3++Ce3+;Sn2++2Fe3+===2Fe2++Sn4+
由此可以确定Fe3+、Ce4+、Sn4+三种离子的氧化性由强到弱的顺序( )
A.Sn4+、Fe3+、Ce4+ B.Sn4+、Ce4+、Fe3+
C.Ce4+、Fe3+、Sn4+ D.Fe3+、Sn4+、Ce4+
查看答案和解析>>
科目:高中化学 来源:2017届湖北省老河口市高三10月月考化学卷(解析版) 题型:填空题
假定元素周期表是有限的,根据已知的元素周期表的某些事实和理论可归纳出一些假说。
(1)已知元素周期表中的各周期可排元素种类如下:
周期 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
元素种类 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
人们预测元素周期表第八周期将来也会排满,那么该周期排满后的元素种数是 。
A.18 B.32 C.50 D.无法判断
(2)根据周期表中每个周期非金属元素的种数(把稀有气体元素看做非金属元素),预测周期表中应该有 种非金属元素,还有 种未发现。未发现的非金属元素处于 周期 族。
(3)小明同学所在的化学探究小组,在查阅相关资料后归纳出元素周期表的另一种画法——三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置。

回答下列问题:
①请在图中将过渡 元素所在的位置涂黑。
元素所在的位置涂黑。
②画出B元素价电子排布图 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com