
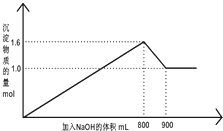
 ��1L A1Cl3��FeCl3�Ļ����Һ����μ���NaOH ����Һ���������������ʵ����ͼ�����Һ������Ĺ�ϵ��ͼ��ʾ���ش��������⣺
��1L A1Cl3��FeCl3�Ļ����Һ����μ���NaOH ����Һ���������������ʵ����ͼ�����Һ������Ĺ�ϵ��ͼ��ʾ���ش��������⣺| ���� | A1Cl3 | FeCl3 |
| ���ʵ���Ũ�� mol/L |
���� ��1����ʼ����NaCl������ΪFe��OH��3��Al��OH��3�����������ټ���NaOH������Ӧ��Al��OH��3+NaOH=NaAlO2+2H2O��
��2������NaOH ��Һ800mL ��900mL ֮�䷢����Ӧ��Al��OH��3+NaOH=NaAlO2+2H2O��
��3����ͼ��֪Fe��OH��3Ϊ1mol����Al��OH��3Ϊ1.6mol-1mol=0.6mol������ԭ���غ����FeCl3��A1Cl3�����ʵ��������������������ʵ���Ũ�ȣ�
��4��800mLʱ��������������������غ����n��NaOH������������NaOH��Һ���ʵ���Ũ�ȣ�
��� �⣺��1����ʼ����NaCl������ΪFe��OH��3��Al��OH��3�����������ټ���NaOH������Ӧ��Al��OH��3+NaOH=NaAlO2+2H2O��900mLʱ����������ȫ�ܽ⣬��Һ�еij�����Fe��OH��3����Һ�е�������NaCl��NaAlO2��
�ʴ�Ϊ��Fe��OH��3��NaCl��NaAlO2��
��2������NaOH ��Һ800mL ��900mL ֮�䷢����Ӧ��Al��OH��3+NaOH=NaAlO2+2H2O����Ӧ���ӷ���ʽΪΪ��Al��OH��3+OH-=AlO2-+2H2O��
�ʴ�Ϊ��Al��OH��3+OH-=AlO2-+2H2O��
��3����ͼ��֪Fe��OH��3Ϊ1mol����Al��OH��3Ϊ1.6mol-1mol=0.6mol������ԭ���غ㣬��n��FeCl3��=n[Fe��OH��3]=1mol��c��FeCl3��=$\frac{1mol}{1L}$=1mol/L��
n��A1Cl3��=n[Al��OH��3]=0.6mol��c��AlCl3��=$\frac{0.6mol}{1L}$=0.6mol/L��
�ʴ�Ϊ��c��FeCl3��=1mol/L��c��AlCl3��=0.6mol/L��
��4��800mLʱ��������������������غ㣬n��NaOH��=3n[Fe��OH��3]+3n[Al��OH��3]=4.8mol����c��NaOH��=$\frac{4.8mol}{0.8L}$=8mol/L��
�ʴ�Ϊ��8mol/L��
���� �����Ի�ѧ��Ӧͼ��Ϊ���壬���������йؼ��㣬�ؼ�����ȷ���η����ķ�Ӧ��ע�������غ㷨����������������ѧ��������������Ϣ��ȡ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
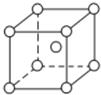 ��֪A��B��C��D��E�������ڱ���ǰ������ԭ���������������Ԫ�أ�����A��B��C��ͬһ���ڵķǽ���Ԫ�أ�D��C�����γ����ֳ��������Ӿ��壬D����������C�������Ӿ�����ͬ�ĵ��Ӳ�ṹ��AC2Ϊ�Ǽ��Է��ӣ�B��C���⻯��ķе������ͬ����������Ԫ���⻯��ķе�ߣ�E��ԭ������Ϊ24��ECl3����B��C���⻯���γ�����λ�������M����������������ʵ���֮��Ϊ2��1������������λ����磮���������������ش��������⣺������ʱ��A��B��C��D��E������Ӧ��Ԫ�ط��ű�ʾ��
��֪A��B��C��D��E�������ڱ���ǰ������ԭ���������������Ԫ�أ�����A��B��C��ͬһ���ڵķǽ���Ԫ�أ�D��C�����γ����ֳ��������Ӿ��壬D����������C�������Ӿ�����ͬ�ĵ��Ӳ�ṹ��AC2Ϊ�Ǽ��Է��ӣ�B��C���⻯��ķе������ͬ����������Ԫ���⻯��ķе�ߣ�E��ԭ������Ϊ24��ECl3����B��C���⻯���γ�����λ�������M����������������ʵ���֮��Ϊ2��1������������λ����磮���������������ش��������⣺������ʱ��A��B��C��D��E������Ӧ��Ԫ�ط��ű�ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | С��2��7 | B�� | ����2��7 | C�� | ����2��7 | D�� | ���϶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ֻ�Т� | B�� | ֻ�Т٢� | C�� | ֻ�Тڢ� | D�� | �٢ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ӽ� | B�� | ���ۼ� | C�� | ��λ�� | D�� | ���»��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ����� | a | b | c |
| �Ͻ�������g�� | 0.51 | 0.765 | 0.918 |
| ���������mL�� | 560 | 672 | 672 |
 ��3����c�������������м���78mL 1.0mol/L������������Һ����ǡ��ʹʣ��Ͻ��е�����ȫ�ܽ⣮
��3����c�������������м���78mL 1.0mol/L������������Һ����ǡ��ʹʣ��Ͻ��е�����ȫ�ܽ⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol����ϩ���е�ԭ����ĿΪ6NA | |
| B�� | ��״����1 L������ȫȼ�պ�ָ���ԭ״̬��������̬���ʷ�����Ϊ$\frac{5{N}_{A}}{22.4}$ | |
| C�� | 1 mol����10NA������ | |
| D�� | 2.8 g��ϩ�ͱ�ϩ�Ļ������������̼ԭ����Ϊ0.2NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com