
【题目】下列离子方程式正确的是( )
A.用铝粉和NaOH溶液反应制取少量H2:Al+2OH-= AlO2-+H2↑
B.过量铁粉与一定量稀硝酸反应:Fe+4H++NO3-=Fe3++NO↑+2H2O
C.澄清石灰水中加入过量NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
D.向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As 原子的核外电子排布式_____________。
(2)根据元素周期律,原子半径 Ga_____________As(填“>”或“<”,下同),第一电离能 Ga_____________As。
(3)AsCl3 分子的立体构型为_____________。
(4)锗(Ge)是典型的半导体元素,比较下表中锗卤化物的熔点和沸点,分析其变化规律及原因_____________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约 400 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下。
![]()
请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。
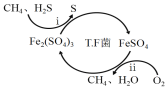
(1)过程i的离子反应方程式为_______________________。
(2)已知:①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
pH | 0.7 | 1.1 | 1.5 | 1.9 | 2.3 | 2.7 |
Fe2+的氧化速/g·L-1·h-1 | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 |
在转化脱硫中,请在上表中选择最佳pH范围是_______<pH<_______,这样选择的原因是:____。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合下图回答问题。
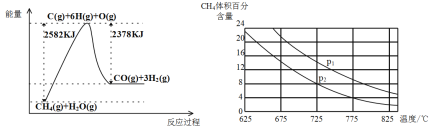
(3)①该过程的热化学方程式是___________。
②比较压强P1和p2的大小关系:P1________P2(选填“>”“<”或“=”)。
③在一定温度和一定压强下的体积可变的密闭容器中充入1mol CH4和1mol的水蒸气充分反应达平衡后,测得起始时混合气的密度是平衡时混合气密度的1.4倍,若此时容器的体积为2L,则该反应的平衡常数为______________(结果保留2位有效数字)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.H2提纯:将CO2和H2分离得到H2的过程如示意图
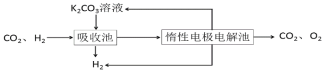
(4)①吸收池中发生反应的离子方程式是______________。
②结合电极反应式,简述K2CO3溶液的再生原理:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。利用下图所示装置(图中夹持仪器略去)进行牙膏样品中碳酸钙的定量测定实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。

依据实验过程回答下列问题:
(1)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:____
(2)C中反应生成BaCO3的化学方程式是__________________。
(3)下列各项措施中,不能提高测定准确度的是_________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(4)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为__________。
(5)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是_____
(6)上述实验中用到的氢氧化钠以食盐为原料进行生产的。食盐在生产生活中应用广泛,下图是以食盐为原料并综合利用的某些过程如下图所示。

I.除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填字母) __________。
a.Na2CO3 b.NaOH c.BaCl2
II.电解饱和食盐水可得到H2和另外两种产物,这两种物质相互反应的离子方程式为 ____________,欲从饱和食盐水中获得食盐晶体,可采用的实验方法是__________。
III.气体X可增大饱和食盐水吸收CO2的量,有利于NaHCO3晶体的生成和析出,X的化学式是________。
IV.下列有关NaHCO3和纯碱的说法正确的是__________(填字母)
A.NaHCO3属于盐类,纯碱属于碱
B.分别往同浓度的NaHCO3溶液和纯碱溶液中滴加稀盐酸,产生气泡的速率相同
C.常温下在水中的溶解度,NaHCO3大于纯碱
D.除去NaHCO3溶液中的纯碱,应往溶液中通入足量的CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ag2O2是银锌碱性电池的正极活性物质,用如下方法制备:在过量KOH溶液中加入适量AgNO3溶液,生成Ag2O沉淀;保持反应温度为80℃,再边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中。反应完全后,过滤、洗涤、真空干燥就可得到固体样品。整个制备过程可用下列化学反应方程式描述:2AgNO3+4KOH+K2S2O8 ![]() Ag2O2↓+2KNO3 +2K2SO4+2H2O。在上述制备过程中,沉淀表面吸附物质不含有( )
Ag2O2↓+2KNO3 +2K2SO4+2H2O。在上述制备过程中,沉淀表面吸附物质不含有( )
A. KNO3B. K2SO4C. KOHD. AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组将下列装置如图连接,E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:

(1)电源A极的名称是____,丁中____(填“X”或“Y”)极颜色会加深。
(2)欲用丙装置给铜镀银,H应该是____,电镀液的主要成分是____(填化学式)。
(3)如果收集乙装置中产生的气体,相同条件下两种气体的体积比是___。
(4)甲装置为使用过的铅蓄电池,充电后电极D应与用电器的____(填“正”或“负”)极连接,电极C上的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为前四周期的元素。其中,A元素和B元素的原子都有一个未成对电子,![]() 比
比![]() 少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为红色固体,可通过“湿法冶金”而得。请回答下列问题:
少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为红色固体,可通过“湿法冶金”而得。请回答下列问题:
![]() 分子中心原子的杂化类型是 ______ 。
分子中心原子的杂化类型是 ______ 。
![]() 元素的原子的外围电子排布式为 ______ ;如图所示为F与Au以3:1形成的合金晶胞图,在图中的括号内对应的元素符号a: _____、b:_____。
元素的原子的外围电子排布式为 ______ ;如图所示为F与Au以3:1形成的合金晶胞图,在图中的括号内对应的元素符号a: _____、b:_____。

![]() 、D元素最高价氧化物对应的水化物的酸性强弱: ______
、D元素最高价氧化物对应的水化物的酸性强弱: ______ ![]() ______
______ ![]() 填化学式
填化学式![]() 。
。
![]() 用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式: ______ 。
用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式: ______ 。
![]() 分子R是由C元素与氢元素形成的18电子分子,R的电子式为 ______ 。
分子R是由C元素与氢元素形成的18电子分子,R的电子式为 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液,有关微粒的物质的量变化如图,根据图示判断,下列说法错误的是( )

A.在P点时,c(H2A)+c(HA-)+c(A2-)+c(OH-)=c(Na+)+c(H+)
B.当V(NaOH)=20 mL时,c(OH-)=c(H+)+c(HA-)+2c(H2A)
C.当V(NaOH)=30 mL时,2c(Na+)=3[c(HA-)+c(A2-)+c(H2A)]
D.当V(NaOH)=40 mL时,c(Na+)>c(A2-)>c(HA-)>c(H2A)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各实验装置的叙述中,不正确的是( )
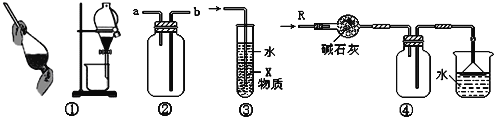
A. 装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
B. 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
C. 装置①可用于分离C2H5OH和H2O的混合物
D. 装置④可用于干燥、收集NH3,并吸收多余的NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com