
| A. | pH<7的溶液中:Al3+、K+、SO32-、Cl- | |
| B. | 加入铝粉能放出氢气的溶液中:CO32-、AlO2-、I-、NO3- | |
| C. | 能使pH试纸变深蓝色的溶液中:S2-、SO32-、S2O32-、SO42- | |
| D. | 由水电离出的[OH-]=1×10-13mol/L的溶液中:Fe2+、NH4+、ClO-、Cl- |
分析 A.常温下pH<7,溶液呈酸性,离子之间不反应且和氢离子不反应的能大量共存;
B.加入铝粉能放出氢气的溶液中含有弱氧化性酸或含有强碱溶液;
C.使pH试纸变蓝色的溶液呈碱性;
D.由水电离出的[OH-]=1×10-13mol/L的溶液呈强酸性或强碱性.
解答 解:A.常温下pH<7,溶液呈酸性,离子之间不反应且和氢离子不反应的能大量共存,Al3+、SO32-发生水解反应且SO32-和H+反应生成弱电解质而不能大量共存,故A错误;
B.加入铝粉能放出氢气的溶液中含有弱氧化性酸或含有强碱溶液,酸性条件下不能大量存在CO32-、AlO2-且
I-、NO3-发生氧化还原反应而不能大量共存,故B错误;
C.使pH试纸变蓝色的溶液呈碱性,这几种离子之间不反应且和氢氧根离子不反应,所以能大量共存,故C正确;
D.由水电离出的[OH-]=1×10-13mol/L的溶液呈强酸性或强碱性,酸性条件下ClO-、Fe2+发生氧化还原反应而不能大量共存,碱性条件下Fe2+、NH4+不能大量共存,故D错误;
故选C.
点评 本题考查离子共存,为高频考点,涉及复分解反应、氧化还原反应,明确物质性质及离子反应条件是解本题关键,易错选项是B,注意能和铝粉反应生成的氢气的溶液不能为硝酸,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ②③⑥ | C. | ①④⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐类水解是酸碱中和反应的逆反应 | |
| B. | 盐类水解的结果使盐溶液不一定呈中性 | |
| C. | 盐类水解的结果使水的电离程度减小 | |
| D. | 盐类水解的结果使水的电离程度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| B. | 加碘食盐中加入的I2有利于防止地方缺碘病 | |
| C. | 二氧化硫有漂白性,常用作棉、麻、纸张的漂白 | |
| D. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 含氧化合物 |
| A | K2O2 |
| B | H2O2 |
| C | Na2CO3 |
| D | Na2O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
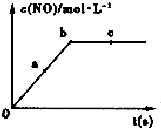 氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位、工业制硝酸的主要反应之一是:
氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位、工业制硝酸的主要反应之一是:| 深度/mol•L-1 时间/min | C(NH3) | c(O2) | c(NO) | c(H2O) |
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第2min | 3.2 | 4.5 | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | Ⅳ | ⅤA | ⅥA | ⅦA | 0 | |
| 二周期 | ① | ② | | |||||
| 三周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
 ,④的元素名称镁,②与⑦形成的化合物属于共价(填“离子”“共价”)化合物.
,④的元素名称镁,②与⑦形成的化合物属于共价(填“离子”“共价”)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中Cu2+浓度增大 | B. | 溶液中Cu2+数目增大 | ||
| C. | 该硫酸铜晶体体积不变 | D. | 溶液的蓝色不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com