

 .
. ,用电子式表示Y的形成过程
,用电子式表示Y的形成过程 .
.分析 由短周期元素在周期表的位置可知,①~⑩分别为H、Be、C、N、O、F、Na、Al、Cl、Ar,
(1)⑨为Cl,原子结构中有3个电子层,最外层电子数7;
(2)具有相同电子排布的离子中,原子序数大的离子半径小,电子层越多的原子半径越大,同周期从左向右原子半径减小;非金属性越强,对应氢化物越稳定;
(3)HF分子间含氢键;
(4)①⑤两元素可以形成原子个数比1:1和2:1的化合物X和Y,X为H2O2,Y为H2O,为共价化合物;
(5)由①③⑤三种元素组成的化合物之一Z,是生活中常见的有机化合物,它具有特殊的香味,Z为乙醇,与Na反应生成氢气.
解答 解:(1)⑨在周期表中的位置是第三周期ⅦA族,其原子结构示意图为 ,故答案为:第三周期ⅦA族;
,故答案为:第三周期ⅦA族; ;
;
(2)具有相同电子排布的离子中,原子序数大的离子半径小,则⑤⑥⑦的简单离子半径最小的是Na+,电子层越多的原子半径越大,同周期从左向右原子半径减小,则原子半径最小的为F,F的非金属性最强,则⑤⑥⑨三种元素的气态氢化物最稳定的是HF,
故答案为:Na+;F;HHF;
(3)⑥对应的气态氢化物沸点高于同主族元素对应的气态氢化物,原因是HF分子间存在氢键,氢键强于范德华力,
故答案为:HF分子间存在氢键,氢键强于范德华力;
(4)①⑤两元素可以形成原子个数比1:1和2:1的化合物X和Y,X为H2O2,为共价化合物,其电子式为 ;Y为H2O,用电子式表示Y的形成过程 为
;Y为H2O,用电子式表示Y的形成过程 为 ,
,
故答案为: ;
; ;
;
(5)由①③⑤三种元素组成的化合物之一Z,是生活中常见的有机化合物,它具有特殊的香味,Z为乙醇,与Na反应生成氢气,反应为2CH3CH2OH+2Na→2CH3CHONa+H2↑,故答案为:2CH3CH2OH+2Na→2CH3CHONa+H2↑.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素的性质、元素周期律及元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意规律性知识及化学用语的应用,题目难度不大.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:填空题
 Cu3N具有良好的电学和光学性能,其晶胞结构如图,Cu+半径为apm,N3-半径为bpm,Cu+和N3-都是紧密接触的刚性小球,则N3-的配位数为6,Cu3N的密度为$\frac{1.03×1{0}^{32}}{4(a+b)^{3}{N}_{A}}$g•cm-3.(化为最简式)
Cu3N具有良好的电学和光学性能,其晶胞结构如图,Cu+半径为apm,N3-半径为bpm,Cu+和N3-都是紧密接触的刚性小球,则N3-的配位数为6,Cu3N的密度为$\frac{1.03×1{0}^{32}}{4(a+b)^{3}{N}_{A}}$g•cm-3.(化为最简式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 测定时刻/s 浓度 | t1 | t2 | t3 | t4 |
| c(A)/(mol•L-1) | 6 | 3 | 2 | 2 |
| c(B)/(mol•L-1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol•L-1) | 1 | 2.5 | 3 | 3 |
| A. | 在t3 s时反应已经停止 | |
| B. | t3~t4 s内正、逆反应速率不相等 | |
| C. | 在容器中发生的反应为A(g)+B(g)??C(g) | |
| D. | 在t2~t3 s内A的平均反应速率为$\frac{1}{{t}_{3}-{t}_{2}}$ mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
 .
. 或
或
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(NO2)/mol•L-1 | 0.10 | 0.20 | 0.20 |
| C(SO2)/mol•L-1 | 0.10 | 0.10 | 0.20 |
| A. | 容器甲中的反应在前2 min的平均速率v(SO2)=0.05 mol•L-1•min-1 | |
| B. | 达到平衡时,容器丙中正反应速率与容器甲相等 | |
| C. | 温度升至90℃,上述反应平衡常数为1.56,则反应的△H>0 | |
| D. | 容器乙中若起始时改充0.10 mol•L-1 NO2和0.20mol•L-1 SO2,达到平衡时c(NO)与原平衡相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
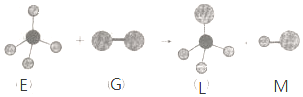
| A. | 常温常压下,E是一种无色无味的气体 | |
| B. | 干燥的G能漂白有色物质 | |
| C. | 在光照条件L能与 G继续发生与上述类似的反应 | |
| D. | 上述反应类型是取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com