
����������25��ʱ��ˮ��Һ�еĵ��볣�����±������볣��������ƽ���ƽ�ⳣ�����뻯ѧƽ�����ơ�����K1��ʾ��һ������ĵ��볣����K2��ʾ�ڶ�������ĵ��볣������
| ���� | �����ᣨHCN�� | ̼�ᣨH2CO3�� | ����ᣨHF�� |
| ����ƽ�ⳣ��Kֵ | 6.2��10-10��K�� | 4.2��10-7��K1�� 5.6��10-11��K2�� | 6.61��10-4��K�� |
����ѡ����ȷ����
A. ��������Һ��ͨ�����CO2��F-+H2O+CO2=HF+HCO3-
B. Na2CO3��Һ�У�2c��Na+��=c��CO32-��+c��HCO3-��+c��H2CO3��
C. �к͵��������pH�������ᣨHCN��������ᣨHF������NaOH����ǰ�ߴ��ں���
D. ��Ũ�ȵ�NaCN��NaF��Һ��pHǰ��С�ں���

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��A����Է�������Ϊ84���ش��������⣺
��1������������A�����������ϣ��������ʵ���һ�������ȼ������������������ȵ���(�����)____ ____��
a��C7H12O2 b��C6H14 c��C6H14O d��C7H14O3
��2������AΪ��������HBr�ӳɺ�ֻ�ܵõ�һ�ֲ���Ҹ�����һ�ȴ���ֻ��һ�֡�
��A�Ľṹ��ʽΪ________________��
������A��Br2��CCl4��Һ��Ӧ����B��B��NaOH�Ĵ���Һ���ȿɵõ�D��D����������ԭ�ӡ� ��д����B�Ʊ�D�Ļ�ѧ����ʽ��__ ________________��
��д����B�Ʊ�D�Ļ�ѧ����ʽ��__ ________________��
��B������NaOHˮ��Һ��ȫ��Ӧ�������л���E���÷�Ӧ�Ļ�ѧ����ʽ��____________________________��E���Ҷ����Ĺ�ϵ��_______________��
��3�����˴Ź���������ʾ����A�����鲻ͬ�ķ壬�������Ϊ3��2��1����A������Ϊ__________________��
��4����A����ʹ��ˮ��ɫ������һ�ȴ���ֻ��һ�֣���A�Ľṹ��ʽΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ڹ�������������Ӧ��ֻ����һ��һ�ȴ������(����)
A��2������ B��������
C��2��2�������� D��2��2��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ���¶��£�����������������Һһ�������Ե���
A. pH<7��ij���ʵ�ˮ��Һ B. �ӷ�̪������ɫ����Һ
C. �������Al��Ӧ�ų�H2����Һ D. c��H+��>c��OH-�����������ʵ�ˮ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ⷨ�������Ժ�����ˮ����Ҫ����Cr2O72-��ʱ�����������������������������д��ڷ�ӦCr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O�����Cr3+��Cr��OH��3��ʽ��ȥ������˵������ȷ����
A. ������ӦΪFe-2e-=Fe2+
B. ����������ҺpH����仯
C. ��������Fe��OH��3��������
D. ��·��ÿת��12 mol���ӣ������1 mol Cr2O72-����ԭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ�����������������Ⱦ���������·�Ӧ��CH4��g��+2NO2��g�� N2��g��+CO2��g��+2H2O��g�� ��H=b kJ��mol�����¶�T1��T2ʱ���ֱ�0.50 mol CH4��1.2 mol NO2�������Ϊ1 L���ܱ������У����n��CH4����ʱ��仯��ͼ������˵����ȷ����
N2��g��+CO2��g��+2H2O��g�� ��H=b kJ��mol�����¶�T1��T2ʱ���ֱ�0.50 mol CH4��1.2 mol NO2�������Ϊ1 L���ܱ������У����n��CH4����ʱ��仯��ͼ������˵����ȷ����
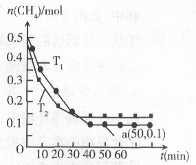
A. T1>T2 B. b>0 C. K��T1��>K��T2�� D. a��ʱNO2��ת����Ϊ33.3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
Na2SO3��һ����Ҫ����ԭ�ϡ�
��1����1.0 moL��L��Na2SO4��Һ�еμӷ�̪����Һ��Ϊ��ɫ�������ӷ���ʽ������ԭ��________________________��
��2����ҵ��Na2SO3���������������е�SO2��������ͨ��1L 1.0 mol��L��Na2SO3��Һ����ҺpH���ϼ�С������ҺpHԼΪ6ʱ������SO4�����������½���Ӧ�����ռ����д�����
�ٵ������ռ�������8.96 L SO2������ɱ�״��������ʱ��Һ��c��CO32-����c��HSO3-��=_________��
����ͼΪ��ͬ������Ͳ�ͬŨ�ȵ�Na2SO3������Ч�ʵ�Ӱ�졣

����˵���У���ȷ���� ��
a. Na2SO3Ũ��Խ������Ч��Խ��
b. ��ͬ�����£������������NaOH������Ч�����
c. ������ͬŨ�ȵ�Na2SO3��Һ���¶�Խ������Ч��Խ��
d. ����ҺpHԼΪ6ʱ����ʱ������Һ������ֻ��NaHSO2
����Һ���������½����м���������ͬʱ�õ�Ũ��SO2�����������Ļ�ѧ����ʽ��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ε���������ȷ����(����)
��������ζ�����ˮ�����̬���ʲ�����ľ�һ��ʹ�á�����ζ������ӻ��������ζ�����Ӧ���������ᷴӦ
A���٢ۢ�
B���٢ڢ�
C���٢ڢۢ�
D���٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
25��ʱ��ˮ�ĵ���ﵽƽ�⣺H2O H����OH��������������ȷ���ǣ� ��
H����OH��������������ȷ���ǣ� ��
A����ˮ�м��백ˮ��ƽ�������ƶ���c(OH��)����
B����ˮ�м������������������ƣ�c(H��)����KW����
C����ˮ�м�����������CH3COONa��ƽ�������ƶ���c(H��)����
D����ˮ���ȣ�KW����pH����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com