
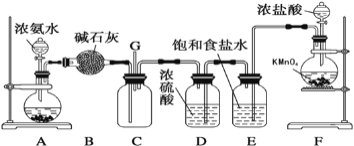
【题目】某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式为___________________;
(2)盛放浓盐酸的装置的名称是____________;A装置中的固体可能是___________;
(3)通入C装置的两根导管左边较长、右边较短,目的是_____________________;
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:___________________________。
【答案】2MnO4-+10Cl-+16H+=Mn2++5Cl2↑+8H2O 分液漏斗 碱石灰或生石灰等 使密度大的氯气与密度小的氨气较快地均匀混合 3Cl2+8NH3=N2+6NH4Cl
【解析】
A装置中产生氨气,通入B的碱石灰干燥后进入C装置;在F中高锰酸钾与浓盐酸反应产生氯气,通过E中饱和食盐水除去氯气中混有的杂质HCl,再通过D装置的浓硫酸对氯气进行干燥,进入C,与氨气混合发生氧化还原反应产生NH4Cl及N2。
(1)装置F中高锰酸钾与浓盐酸反应产生氯气,根据电子守恒、电荷守恒及原子守恒,可得发生反应的离子方程式为2MnO4-+10Cl-+16H+=Mn2++5Cl2↑+8H2O;
(2)根据装置图示可知盛放浓盐酸的装置的名称是分液漏斗;A装置用来制取氨气,A中的固体可能是碱石灰或生石灰、固体NaOH等碱性物质;
(3)通入C装置的两根导管左边较长、右边较短,目的是使密度大的氯气与密度小的氨气较快地均匀混合,以便于充分反应;
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,说明氯气与氨气反应生成氯化铵和氮气,根据电子守恒及原子守恒,可得该反应的方程式:3Cl2+8NH3═N2+6NH4Cl。


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
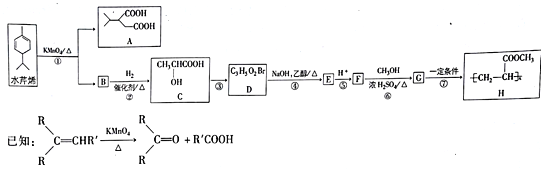
【题目】水芹烯是一种具有祛痰、抗菌、杀虫作用的添加剂,由水芹烯合成聚合物H的路线如图所示。
回答下列问题:
(1)水芹烯的分子式为_______ ,C的系统命名为_________________,反应④的反应类型为____。
(2)D分子中的官能团为(写名称)_______________,B的结构简式为___________ 。
(3)反应⑥的化学反应方程式为___________________________________。H在NaOH水溶液中发生水解反应的化学方程式为________________________________________。
(4)M是G的同分异构体,且能与NaHCO3反应生成CO2,则M的可能结构有________种(考虑立体异构)
(5)乙酸异丙酯CH3COOCH(CH3)2是重要的有机化工中间体,写出以2-甲基-2-丁烯为原料(其他无机试剂任选)制备乙酸异丙酯的合成路线_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为三种短周期元素,A、B在同周期, A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构。下列说法中正确的是
A.原子序数:A>B>CB.原子半径:A>B>C
C.离子半径:A2->C->B2+D.原子核外最外层电子数:A>C>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4-二氧杂螺[2.2]丙烷的结构简式为![]() ,有关该有机物的说法正确的是
,有关该有机物的说法正确的是
A. 三个碳原子位于同一直线
B. 二氯代物有2种
C. 所有原子位于同一平面
D. 与其互为同分异构体的化合物有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制250mL 0.5mol/L NaOH溶液,在下列仪器中:A. 托盘天平 B. 量筒 C.烧杯 D. 玻璃棒 E. 漏斗 F. 500mL容量瓶 G. 药匙 H. 250mL容量瓶 I. 胶头滴管 J. 坩埚。需要用到的仪器有______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
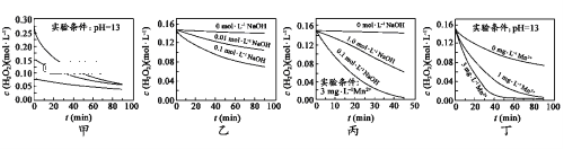
A. 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B. 图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C. 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 图丁表明,碱性溶液中,Mn2+越大,H2O2分解速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,△E1=393.5kJ,△E2=395.4kJ,下列说法正确的是
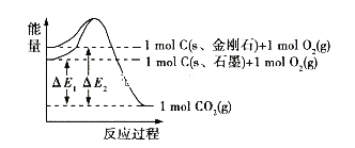
A. 1mol石墨完全转化为金刚石需吸收1.9kJ热量
B. 石墨转化为金刚石发生的是物理变化
C. 金刚石与O2反应生成CO2放出的热量比石墨与O2反应生成CO2放出的热量多
D. 1mol金刚石具有的能量低于1mol石墨具有的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,发生反应:A(s)+2B(g)![]() C(g)+D(g),当下列物理量不再变化时,不能表明反应已达平衡的是
C(g)+D(g),当下列物理量不再变化时,不能表明反应已达平衡的是
A. 混合气体的压强B. 混合气体的密度
C. 混合气体的平均相对分子质量D. 固体A的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) △H=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式:___________________________;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
,请写出此反应的热化学方程式:___________________________;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 15 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0~5min内,以CO2表示的该反应速率v(CO2)=_____,该条件下的平衡常数K=__________。
②第15 min后,温度调整到T2,数据变化如上表所示,则T1_______ T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com