
(1)已知常温下,A酸的溶液pH=a,B碱的溶液pH=b,回答下列问题:
①若A为醋酸,B为氢氧化钠,且a=4,b=10,两者等体积混合,则混合前c(CH3COOH) c(NaOH )(填“<、=或>”,下同);混合后溶液的pH 7。
②若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性,则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。(2)①现有25℃时等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,均恰好中和,则V1、V2、V3的大小关系是 ;
②另有25℃,等体积等物质的量浓度的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,混合后溶液均呈中性,则V1、V2、V3的大小关系是 ;③室温下,若生成同浓度的NaCl与NH4Cl溶液各1L,则溶液中离子总数N(NaCl) N(NH4Cl)。(填“<、=或>”)
(1)①>;<(每空1分) ②M++H2O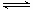 MOH+H+(2分)
MOH+H+(2分)
(2)V1=V2<V3;V1>V2>V3;>(每空2分)
【解析】
试题分析:(1)①醋酸是弱酸,存在电离平衡,因此pH=4的醋酸溶液的浓度大于10-4mol/L。氢氧化钠是强碱,完全电离,则常温下pH=10的氢氧化钠溶液浓度等于10-4mol/L,因此混合前c(CH3COOH)>c(NaOH );两者等体积混合后醋酸过量,溶液显酸性,所以混合后溶液的pH<7。
②由于a+b=14,两者等体积混合后溶液显碱性,若溶液是由于水解显碱性,则酸一定是弱酸。但如果算是弱酸,则酸一定过量,溶液应该显酸性,才假设不正确。所以只能是碱过量导致溶液显碱性,因此碱是弱碱,则生成的盐中M+水解,该水解反应的离子方程式为M++H2O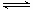 MOH+H+。
MOH+H+。
(2)①氢氧化钡和氢氧化钠是强碱,在溶液体积和pH相等的条件下消耗的盐酸的物质的量相同,所以在盐酸的浓度相等的条件下,消耗盐酸的体积是V1=V2;氨水是弱碱,存在电离平衡,所以在pH相等的条件下氨水的浓度大于氢氧化钠溶液的浓度,消耗的盐酸体积最多,因此V1、V2、V3的大小关系是V1=V2<V3;
②氢氧化钡和氢氧化钠是强碱,在溶液体积和物质的量浓度相等的条件下消耗的盐酸的物质的量前者多,因此在盐酸的浓度相等的条件下,消耗盐酸的体积是V1>V2;氨水是弱碱,与盐酸恰好反应时溶液显酸性,若要显中性,则氨水应该是过量的,所以消耗盐酸的体积应该是V2>V3,则V1、V2、V3的大小关系是V1>V2>V3;
③由于氯化铵溶液中NH4+水解,而钠离子不水解,所以等体积等浓度的NaCl与NH4Cl溶液中离子总数大小关系是N(NaCl) >N(NH4Cl)。
考点:考查弱电解质的电离、盐类水解、酸碱中和反应、溶液酸碱性判断


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省宁波市八校高二下学期期末联考化学试卷(带解析) 题型:填空题
(10分)(1)已知常温下,A酸的溶液pH=a,B碱的溶液pH=b,回答下列问题:
①若A为醋酸,B为氢氧化钠,且a=4,b=10,两者等体积混合,则混合前c(CH3COOH) c(NaOH )(填“<、=或>”,下同);混合后溶液的pH 7
②若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性,则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。
(2)①现有25℃时等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,均恰好中和,则V1、V2、V3的大小关系是 ;
②另有25℃,等体积等物质的量浓度的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,混合后溶液均呈中性,则V1、V2、V3的大小关系是 ;室温下,若生成同浓度的NaCl与NH4Cl溶液各1L, 则溶液中离子总数N(NaCl) N(NH4Cl)。(填“<、=或>”)
查看答案和解析>>
科目:高中化学 来源:2013届浙江省宁波市八校高二下学期期末联考化学试卷(解析版) 题型:填空题
(10分)(1)已知常温下,A酸的溶液pH=a,B碱的溶液pH=b,回答下列问题:
①若A为醋酸,B为氢氧化钠,且a=4,b=10,两者等体积混合,则混合前c(CH3COOH) c(NaOH )(填“<、=或>”,下同);混合后溶液的pH 7
②若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性,则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。
(2)①现有25℃时等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,均恰好中和, 则V1、V2、V3的大小关系是 ;
②另有25℃,等体积等物质的量浓度的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,混合后溶液均呈中性,则V1、V2、V3的大小关系是 ;室温下,若生成同浓度的NaCl与NH4Cl溶液各1L, 则溶液中离子总数N(NaCl) N(NH4Cl)。(填“<、=或>”)
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知常温下,A酸的溶液pH=a,B碱的溶液pH=b,回答下列问题:
①若A为醋酸,B为氢氧化钠,且a=4,b=10,两者等体积混合,则
混合前c(CH3COOH) c(NaOH )(填“<、=或>”,下同);混合后溶液的pH 7
②若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显
碱性,则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。
(2)①现有25℃时等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,均恰好中和, 则V1、V2、V3的大小关系是 ;
②另有25℃,等体积等物质的量浓度的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,混合后溶液均呈中性,则V1、V2、V3的大小关系是 ;室温下,若生成同浓度的NaCl与NH4Cl溶液各1L, 则溶液中离子总数N(NaCl) N(NH4Cl)。(填“<、=或>”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com