
㈠(2分)用pH试纸测定溶液pH的正确操作是 ______________________________________
㈡(7分)某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
⑴盛装0.2000 mol/L盐酸标准液应该用 式滴定管。
⑵滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_____________。
⑶ 滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管
④装标准溶液和待测液并调整液面(记录初读数)
⑤用蒸馏水洗涤玻璃仪器
⑥滴定操作
正确的操作顺序为: 。
⑷有关数据记录如下:则NaOH溶液的物质的量浓度为______________mol/L。
|
实验序号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
|
|
滴定前 |
滴定后 |
||
|
1 |
20.00 |
0.50 |
20.55 |
|
2 |
20.00 |
8.00 |
26.00 |
|
3 |
20.00 |
1.40 |
21.35 |
⑸滴定前平视读数,滴定终点时俯视读数,则会使所测碱的浓度值 。
(填“无影响”、“偏高”或“偏低”)。
㈠(2分)将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
㈡(7分)⑴酸 (1分) ⑵锥形瓶内溶液颜色的变化 (1分) ⑶①⑤③④②⑥
⑷0.2000 ⑸偏低 (1分) (除注明外每空2分)
【解析】
试题分析:(1)pH测定溶液的pH时,试纸不能事先润湿,所以用pH试纸测定溶液pH的正确操作是:将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照。
(2)①盐酸显酸性,应该用酸式滴定管盛放。
②准确判断滴定终点是关键,所以滴定过程中,眼睛注视应该注视锥形瓶内溶液颜色的变化。
③根据滴定原理可知,正确的操作顺序是①⑤③④②⑥。
④根据表中数据可知,三次消耗的盐酸体积分别是20.05ml、18.00ml、19.95ml。这说明第二次实验的数据和其它两次相比,误差太大,应该舍去。实验消耗盐酸的平均值是(20.05ml+19.95ml)÷2=20.00ml,则氢氧化钠溶液的浓度是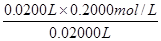 =0.2000mol/L。
=0.2000mol/L。
⑤滴定终点时俯视读数,则读数偏小,所以消耗盐酸的体积减少,则测定结果偏低。
考点:考查溶液pH的测定、中和滴定以及有关误差分析等
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以本部分内容主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用的能力。关于误差分析:根据cB=nB/V可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大。在命题时,有关误差分析的内容既可以以选择题的形式进行考查,也可以以填空题的形式进行考查,既可以考查判断误差导致的结果,也可以考查引起误差的可能原因。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
 (2009?韶关一模)某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验.
(2009?韶关一模)某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验. HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-| 编号 | 盐酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65% | 2.00% | 3.5 |
| 2 | 3.65% | 4.00% | x |
| 3 | 7.30% | 8.00% | 14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硝酸可保存在带橡皮塞的棕色细口瓶中 | B、用pH试纸测定溶液pH时,pH试纸不应事先润湿 | C、配置一定物质的浓度的溶液时,选用的容量瓶规格由需配置的溶液体积决定 | D、中和滴定时为了使滴定终点溶液颜色变化明显,可多滴几滴指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照 | B、将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照 | C、将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照 | D、将一小条试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准比色卡对照 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com