
| 次氯酸 | 磷酸 | 硫酸 | 高氧酸 | |
| 含氧酸 | Cl-OH |  |  |  |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .
.分析 (1)I、原子的电离能越大,表示越难失去电子,故化合价也较低,一般来说,元素的电离能按照第一、第二…的顺序逐渐增加,如果突然增加的比较多,电离的难度增大,这里就是元素的通常的化合价;
II.根据相对分子质量与物质熔沸点的关系以及氢键的存在对物质性质的影响判断;
(2)N元素与O元素的电负性都很强,不同分子中的N原子、O原子与H原子之间都可以形成氢键;
(3)含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强,据此确定酸的结构式;
(4)[Cu(NH3)4]SO4中阴阳离子间形成离子键,配离子[Cu(NH3)4]2+中含有配位键,不同非金属元素之间形成极性共价键.
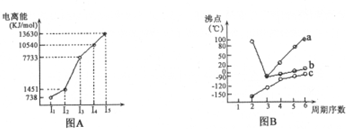
解答 解:(1)I.短周期某主族元素M的第一、第三、第四电离能之间变化不大,第二电离能剧增,且第一电离能很低,则说明该元素原子很难失去第二个电子,最高化合价为+2,应为第IIA族元素,故答案为:ⅡA;
II、在ⅣA~ⅦA中的氢化物里,由于N、O、F电负性大,NH3、H2O、HF因在分子间存在多条结合力较大的氢键,总强度远远大于分子间作用力,故沸点高于同主族其它元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象;
a点所示的氢化物是水,其沸点高是由于在水分子间存在多条结合力较大的氢键,总强度远远大于分子间作用力,所以氧族元素中其它氢化物的沸点不会高于水,故选b;
故答案为:由于N、O、F电负性大,NH3、H2O、HF因在分子间存在多条结合力较大的氢键,总强度远远大于分子间作用力,故沸点高于同主族其它元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象;b;
(2)N元素与O元素的电负性都很强,不同分子中的N原子、O原子与H原子之间都可以形成氢键,如O-H…N、N-H…O、O-H…O、N-H…N,氨水中NH3分子与水分子间形成的可能存在的氢键N-H…O、O-H…N,故答案为:N-H…O、O-H…N;
(3)含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强,亚磷酸是中强酸,所以亚磷酸的结构式分别为: ,故答案为:
,故答案为: ;
;
(4)[Cu(NH3)4]SO4中,[Cu(NH3)4]2+与SO42-之间的化学键为离子键,[Cu(NH3)4]2+中Cu2+与NH3之间的化学键为配位键,N-H为极性共价键,[Cu(NH3)4]SO4,
故答案为:①③⑤.
点评 本题考查的内容较为综合,涉及到配位键、氢键、微粒的空间的结构及配合物化学式的求解等有关知识,注意基础知识的全面掌握,注意氢键、配合物的构成及性质,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 只含有共价键的物质都是共价化合物 | |
| B. | 共价化合物中一定没有离子键 | |
| C. | 凡是在水溶液中能电离出离子的化合物都是离子化合物 | |
| D. | 离子化合物中一定没有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素单质在常温下与水反应不如钠剧烈 | |
| B. | 该元素单质在常温下能与氧气反应 | |
| C. | 该元素最高化合价为+1 | |
| D. | 该元素氢氧化物的水溶液为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,溶液中由水电离的c(H+)=1.0×10-4mol/L,则该溶液有可能是稀盐酸 | |
| B. | NH4Cl溶液加水稀释后,恢复至原温度,pH和Kw均增大 | |
| C. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等 | |
| D. | 在Na2S溶液中加入AgCl固体,白色AgCl转变为黑色Ag2S,则溶液中c(S2-)下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 族 周期 | IA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ||||
| A. | 金属性③>② | B. | ④原子核外有4个电子层 | ||
| C. | 原子半径⑤>③ | D. | 元素①④最高化合价相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 化合物与单质属于包含关系 | |
| B. | 化合物与电解质属于交叉关系 | |
| C. | 分散系与胶体属于包含关系 | |
| D. | 氧化还原反应与化合反应属于并列关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28gCO中含有的分子数为NA | |
| B. | 22.4L空气含有NA个单质分子 | |
| C. | 1mol/L的NaCl溶液含有NA个Na+ | |
| D. | 1mol Na2O2固体中含有的离子总数为4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com