
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)已知:① CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
② C(s)+2H2(g) CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③ 2CO(g) C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式 。
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)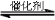 CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如下左图:

①在其他条件不变时,请在上图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图。
②某温度下,将2.0 mol CO2(g)和6.0 mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如下图所示,关于温度和压强的关系判断正确的是 。

A. P3>P2,T3>T2 B. P1>P3,T1>T3
C. P2>P4,T4>T2 D. P1>P4,T2>T3
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的CO和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的平衡常数的表达式为:
该反应的正反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol·L-1,在该条件下CO的平衡转化率为 。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
在容积为2 L的恒容密闭容器中发生反应xA(g) +yB(g)
+yB(g) zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
A.图Ⅱ所知反应xA(g)+yB(g) zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
B.200 ℃时,反应从开始到平衡 的平均速率v(B)=0.02 mol·L-1·min-1
的平均速率v(B)=0.02 mol·L-1·min-1
C.若在图 Ⅰ所示的平衡状态下,再向体系中充入He的瞬间,v正>v逆
Ⅰ所示的平衡状态下,再向体系中充入He的瞬间,v正>v逆
D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数等于0.5
查看答案和解析>>
科目:高中化学 来源:2017届江苏省淮安市高三12月考试化学试卷(解析版) 题型:填空题
高纯氧化铁是现代电子工业的重要材料。以下是用硫酸厂产生的烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原 料制备高纯氧化铁(软磁a-Fe2O3)的生产流程示意图:
料制备高纯氧化铁(软磁a-Fe2O3)的生产流程示意图:
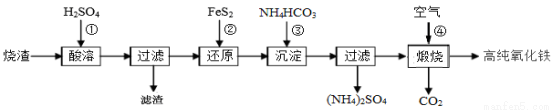
(1)酸浸时,常需将烧渣粉碎、并加入过量H2SO4,其目的是 ;
滤渣的主要成分为 (填化学式)。
(2)加入FeS2时,发生反应②的离子方程式为 。
(3)加入NH4HCO3目的是 。“沉淀”时,pH不宜过高,否则制备的FeCO3中可能混有的杂质是 。检验FeCO3是否洗涤干净的方法是 。
(4)煅烧时,发生反应④的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2017届广东省七校联合体高三上学期第二次联考化学试卷(解析版) 题型:填空题
[化学—选修3:物质结构与性质]碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。
(2)碳在形成化合物时,其键型以共价键为主,原因是 。
(3)C2H2 分子中,共价键的类型有 ,C 原子的杂化轨道类型是 ,写出两个与C2H2具有相同空间构型含碳无机物分子的分子式 。
( 4 )CO 能与金属Fe、Ni分别形成Fe(CO)5、Ni(CO)4,Fe(CO)5中Fe元素的原子核外电子排布为 ,Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂推测Ni(CO)4是 晶体。
(5)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
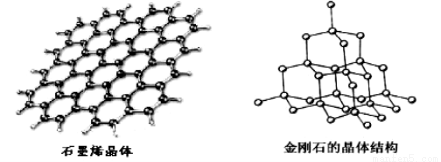
①石墨烯晶体中,每个C 原子连接 个六元环,每个六元环占有 个C 原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接 个六元环,六元环中最多有 个C原子在同一平面。
查看答案和解析>>
科目:高中化学 来源:2017届广东省七校联合体高三上学期第二次联考化学试卷(解析版) 题型:选择题
下列实验操作、现象与所得结论一致的是
实验操作 | 现象 | 结论 | |
A | 向盛有25mL 沸水的烧杯中滴入5~6滴FeCl3饱和溶液,继续煮沸。 | 溶液生成红褐色沉淀 | 制得Fe(OH)3胶体 |
B | 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液。 | 前者溶液变蓝,后者有黄色沉淀。 | KI3溶液中存在平衡:I3- |
C | 将溴乙烷和NaOH乙醇溶液混合加热,产生气体通入酸性KMnO4溶液中。 | 酸性KMnO4溶液褪色。 | 一定产生了乙烯。 |
D | 在滴有酚酞的Na2CO3溶液中,加入CaCl2溶液。 | 溶液褪色。 | CaCl2溶液有酸性。 |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上12月月考化学卷(解析版) 题型:选择题
将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g),一定条件下,现有两个体积均为1.0L恒容密闭容器甲和乙,在甲中充入0.1molCO2和0.2molH2,在乙中充入0.2molCO2和0.4molH2,发生上述反应并达到平衡。该反应中CO2的平衡转化率随温度的变化曲线如图所示。下列说法正确的是
CH3OCH3(g)+3H2O(g),一定条件下,现有两个体积均为1.0L恒容密闭容器甲和乙,在甲中充入0.1molCO2和0.2molH2,在乙中充入0.2molCO2和0.4molH2,发生上述反应并达到平衡。该反应中CO2的平衡转化率随温度的变化曲线如图所示。下列说法正确的是
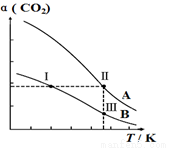
A.反应2CO2(g)+6H2(g) CH3OCH3(g) + 3H2O(g)的 △S<0、△H<0
CH3OCH3(g) + 3H2O(g)的 △S<0、△H<0
B.表 示乙容器CO2的平衡转化率随温度变化的是曲线B
示乙容器CO2的平衡转化率随温度变化的是曲线B
C.体系中c(CH3OCH3):c(CH3OCH3,状态Ⅱ)<2c(CH3OCH3,状态Ⅲ)
D.逆反应速率v逆:v逆(状态Ⅰ)<v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上12月月考化学卷(解析版) 题型:选择题
已知X、M都是中学教材中的常见元素,下列对两个离子反应通式的推断中,其中正确是
(甲)XO3n-+Xn-+H+→X单质+H2O(未配平)
(乙)Mm++mOH-=M(OH)m↓
①若n=1,则XO3n-中X元素为+5价,X位于周期表第ⅤA族
②若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
⑤若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m
A. ①③ B. ④⑤ C. ①② D. ②③
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上模拟四化学试卷(解析版) 题型:选择题
对于反应CO(g)+H2O(g) H2(g)+CO2(g) △H﹤0,在其他条件不变的情况下,下列说法正确的是
H2(g)+CO2(g) △H﹤0,在其他条件不变的情况下,下列说法正确的是
A.加入催化剂,改变了反应的途径,反应的△H也随之改变
B.改变压强(压缩气体或扩大容 积),平衡不发生移动,反应放出的热量不变
积),平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一月考二化学卷(解析版) 题型:实验题
某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分夹持装置已略去)进行实验。 [制取氨气的反应原理: 2NH4Cl+Ca(OH)2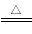 CaCl2+2NH3↑+2H2O]
CaCl2+2NH3↑+2H2O]
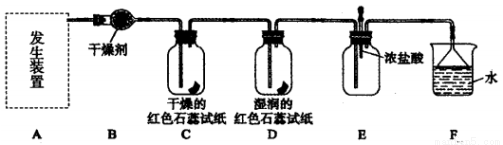
【实验探究】
(1) 利用上述原理,实验室制取氨气应选用下图中_______发生装置进行实验。

(2)B 装置中的干燥剂可选用________( 填“碱石灰”或“浓硫酸”)。
(3)用 5.35 g NH4Cl 固体与足量 Ca(OH)2 反应,最多可制得标准状况下氨气的体积为_________L。( NH4Cl 的摩尔质量为 53.5 g·mol-1)
(4)气体通过 C、D 装置时,试纸颜色会发生变化的是 __________( 填“C”或“D”)。
(5)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2 滴浓盐酸,可观察到的现象是__________。
(6)F装置中倒置漏斗的作用 _____________。
(7)某同学用氨气和滴加酚酞的水做喷泉实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有___________性质(填序号)。
a.还原性 b.极易溶于水 c.与水反应生成碱性物质
(8)氨气的用途很广。如可用氨气处理二氧化氮: 8NH3 + 6NO2 =7N2 + 12H2O该反应中氨气体现________( 填“氧化性”或“还原性”)。请你列举出氨气的另一种用途__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com