
【题目】有机物A是一种纯净的无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A物质18.0g,升温使其汽化,测其密度是相同条 件下H2的45倍。 | A的相对分子质量为____ |
(2)A的核磁共振氢谱如下图:
| A中含有____种氢原子且吸收峰面积比为____ |
(3)另取A18.0g与足量的NaHCO3粉末反应,生成0.2mol CO2,若与足量钠反应则生成0.2molH2。 | A中所含官能团名称为______________ |
(4)将此18.0gA在足量O2中充分燃烧,并使其产物依次 缓缓通过浓硫酸、碱石灰,发现两者依次增重10.8g和26.4g。 | A的分子式___________ |
(5)综上所述,A的结构简式为____ | |
【答案】 90 4 3∶1∶1∶1(与顺序无关) 羟基、羧基 C3H6O3 ![]()
【解析】(1)有机物质的密度是相同条件下H2的45倍,所以有机物质的相对分子质量=45×2=90,故答案为:90;
(2)根据核磁共振氢谱图看出有机物中有4个峰值,则含4种类型的等效氢原子,吸收峰面积比为3∶1∶1∶1,故答案为:4;3∶1∶1∶1;
(3)18.0gA的物质的量=![]() =0.2mol,A和碳酸氢钠反应说明A中含有羧基,生成0.2molCO2,所以含有一个羧基;醇羟基和羧基都可以和金属钠发生反应生成氢气,与足量金属钠反应则生成0.2molH2,羧基或羟基与钠反应生成氢气时,羧基或羟基的物质的量与氢气的物质的量之比为2:1,A与钠反应时,A的物质的量与氢气的物质的量之比是1:1,则说明A中除了含有一个羧基外还含有一个羟基,故答案为:羧基、羟基;
=0.2mol,A和碳酸氢钠反应说明A中含有羧基,生成0.2molCO2,所以含有一个羧基;醇羟基和羧基都可以和金属钠发生反应生成氢气,与足量金属钠反应则生成0.2molH2,羧基或羟基与钠反应生成氢气时,羧基或羟基的物质的量与氢气的物质的量之比为2:1,A与钠反应时,A的物质的量与氢气的物质的量之比是1:1,则说明A中除了含有一个羧基外还含有一个羟基,故答案为:羧基、羟基;
(4)18.0gA的物质的量=![]() =0.2mol,浓硫酸增重10.8g,则生成水的质量是10.8g,生成n(H2O)=
=0.2mol,浓硫酸增重10.8g,则生成水的质量是10.8g,生成n(H2O)= ![]() =0.6mol,所含有n(H)是1.2mol,碱石灰增重26.4g,生成m(CO2)是26.4g,n(CO2)=
=0.6mol,所含有n(H)是1.2mol,碱石灰增重26.4g,生成m(CO2)是26.4g,n(CO2)= ![]() =0.6mol,所以n(C)是0.6mol,则n(A):n(C):n(H)=0.2mol:0.6mol:1.2mol=1:3:6,则有机物中碳个数是3,氢个数是6,根据相对分子质量是90,所以氧原子个数是3,即分子式为:C3H6O3,故答案为:C3H6O3;
=0.6mol,所以n(C)是0.6mol,则n(A):n(C):n(H)=0.2mol:0.6mol:1.2mol=1:3:6,则有机物中碳个数是3,氢个数是6,根据相对分子质量是90,所以氧原子个数是3,即分子式为:C3H6O3,故答案为:C3H6O3;
(5)根据核磁共振氢谱图看出有机物中有4个峰值,则含4种类型的等效氢原子,且氢原子的个数比是3:1:1:1,所以结构简式为:![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下图所示。

(1)该合金的化学式为__________________;
(2)一定条件下,该贮氢材料能快速、可逆地存储和释放氢气,若每个晶胞可吸收 3 个 H2, 这一过程用化学方程式表示为:______________________________________。
(3)下列关于该贮氢材料及氢气的说法中,正确的是_________( 填序号 )
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
C.该材料贮氢时采用常温高压比采用常温常压更好
D.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
(4)晶体铜是面心立方堆积,在铜的一个晶胞中,把顶点上的铜原子换成Au,可得一种合金,该合金也具有储氢功能,储氢时,氢原子进入到Au和Cu原子构成的的四面体空隙中,则达到最大储氢量的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、环境密切相关。下列说法不正确的是
A. 纤维素在人体内水解最终生成葡萄糖
B. 羊绒衫的主要成分是天然纤维
C. 新型能源页岩气的主要成分是甲烷
D. 用太阳能分解水制氢气可减少碳排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学无处不在,下列与化学有关的说法不正确的是( )
A. 酸性条件能加快漂白粉的杀菌消毒速率
B. PVC树脂、光导纤维及碳纤维都是有机高分子材料
C. 用锡焊接的铁质器件,焊接处容易生锈
D. 不法商家制取的“地沟油”无固定的熔沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是常见物质之间的转化,其中A是芯片的主要成分,其对应的单质的结构与金刚石的结构是相似的。
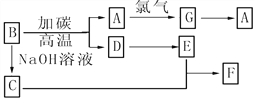
(1)试推测A________、C__________、F__________(写化学式)。
(2)试写出以下的化学方程式,是离子反应的写出离子方程式:
B→A______________;C+E→F______________
(3)在B+碳→A+D的反应中,碳的作用是________,当生成1 mol A时,转移电子的物质的量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A.迄今为止, 化石燃料仍是人类使用的主要能源, 同时也是重要的化工原料。
(1)化石燃料包括煤、石油和_______。化石燃料燃烧时容易引起的环境问题是_______、_______等, 解决这些问题是现今面临的重要挑战。
(2)请将对化石燃料进行综合利用的方法名称填入下表。

_____________________、_________________________、______________________,以上方法中, 属于物理变化的是______( 填序号) 。
(3)由 辛 烷 可 制 得 一 系 列 产 品 : ![]() , 则X 是______; X 在催化剂、加热、加压的条件下可生成乙烯和乙烷, 该反应的化学方程式是____________。
, 则X 是______; X 在催化剂、加热、加压的条件下可生成乙烯和乙烷, 该反应的化学方程式是____________。
(4)碳与水蒸气反应生成水煤气(CO和H2),反应的化学方程式是___________;在此基础上,由水煤气可进一步合成甲醇( CH3OH),则合成甲醇所需的CO 和H2 的体积比是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一价离子组成四种盐,AC、BD、AD、BC的1mol·L-1 溶液,在室温下前两种溶液的pH=7,第三种溶液的pH >7,最后一种溶液的pH< 7,则。
A | B | C | D | |
碱性 | AOH>BOH | AOH<BOH | AOH>BOH | AOH<BOH |
酸性 | HC>HD | HC>HD | HC<HD | HC<HD |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一元强酸X和一元弱酸Y,它们的pH都等于2,各取1L与足量的镁完全反应产生氢气。下列叙述中,正确的是( )
①X能产生较多的氢气 ②Y能产生较多的氢气
③两者产生氢气的量相同 ④开始反应速率X较快
⑤开始反应速率Y较快 ⑥开始反应速率相同
A. ①④ B. ②③ C. ③⑥ D. ②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里迅速制备少量氯气可利用以下反应:2 KMnO4+16 HCl === 2 KCl + 2 MnCl2 + 5 Cl2↑ + 8 H2O 此反应不需要加热,常温下就可以迅速进行,而且对盐酸的浓度要求不高。
(1)用“线桥法”表示出电子转移情况:2 KMnO4+16 HCl === 2 KCl + 2 MnCl2 + 5 Cl2↑ + 8 H2O
______________________
(2)该反应中,氧化剂是__________,还原剂是_________。
(3) 当电子转移的数目为6.02×1023个时生成的氯气的物质的量为 _______mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com