
| | | | | | | | | | | | | | | | |
| | | | | | | | | | | | ① | | ② | | |
| ③ | | | | | | | | | | ④ | | | ⑤ | ⑥ | |
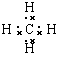 (3)HClO4 (4)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(3)HClO4 (4)2Al+2NaOH+2H2O=2NaAlO2+3H2↑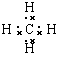 。
。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源:不详 题型:单选题
| A.两种微粒,若核外电子排布完全相同,则其化学性质相同 |
| B.凡单原子形成的稳定离子,一定具有稀有气体元素原子的核外电子排布 |
| C.K+与Cl-通过静电引力结合形成离子化合物KCl |
| D.离子化合物中可以含有共价键,但共价化合物中一定不含离子键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
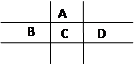
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com