
【题目】碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如图,下列有关该物质的说法正确的是

A. 分子式为C3H4O3
B. 1mol该分子能与2molH2加成
C. 分子中只有极性键
D. 标准状况下8.6g该物质完全燃烧得到6.72LCO2
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】某学习小组设计如下实验方案研究Cu与浓H2SO4的反应(装置中的固定仪器和酒精灯均未画出):
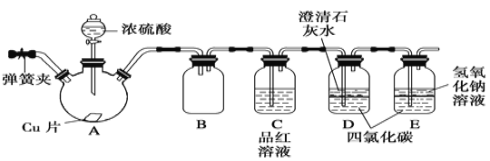
请回答下列问题:
(1)仪器A的名称_________。Cu与浓H2SO4的反应的化学方程式为________________。
(2)D、E中CCl4的作用是___________________。
(3)加热过程中,随着反应的进行,A容器下有少量白色沉淀生成,你认为该沉淀物是_________,分析可能的原因是________________________________________。
(4)实验结束,打开A容器上的弹簧夹,通入一段时间空气,目的是______________。
(5)以下提供了三种制取CuSO4溶液的方法,你认为最合理的是____________(填序号),并且写出该方法对应的化学方程式_____________________________。
① 用铜与浓硫酸制备硫酸铜溶液。
② 将铜片在空气中加热,再溶解在稀硫酸中即可得到硫酸铜溶液。
③ 在硫酸和铜的混合容器中滴加 H2O2 溶液,过滤得硫酸铜溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O=2![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.放电时,电解质溶液中K+向负极移动
B.放电时,电解质溶液中c(OH-)逐渐增大
C.放电时,负极反应为:Zn+4OH--2e-=![]()
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列两种转化途径,某些反应条件和产物已省略。下列有关说法不正确的是
途径① S![]() H2SO4
H2SO4
途径② S![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
A. 途径①反应中体现了浓硝酸的强氧化性和酸性
B. 途径②的第二步反应在实际生产中可以通过增大O2浓度来降低成本
C. 由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol e-
D. 途径②与途径①相比更能体现“绿色化学”的理念是因为途径②比途径①污染相对小且原子利用率高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)CH3OH(g)△H1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)CO(g)+H2O(g)△H3
回答下列问题:
(1)已知△H1=﹣99kJ·mol﹣1,已知△H2=﹣58kJ·mol﹣1,则△H3=______kJ·mol﹣1。
(2)反应①的化学平衡常数K的表达式为______;图1中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母)。
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示。a(CO)值随温度升高而________(填“增大”或“减小”)图2中的压强由大到小为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种物质存在如图所示的转化关系(图中“→”表示一步转化)。下列各组物质中,不能满足此转化关系的是( )
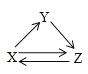
物质 选项 | X | Y | Z |
A | Al | Al2O3 | NaAlO2 |
B | Fe | FeCl3 | FeCl2 |
C | C | CO | CO2 |
D | Cl2 | HCl | NaCl |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-a kJ·mol-1。下列说法正确的是( )
2SO3(g) ΔH=-a kJ·mol-1。下列说法正确的是( )
A.在接触法制取硫酸工艺中,该反应在沸腾炉内发生
B.如果用 18O2代替O2发生上述反应,则经过一段时间可测得容器中存在S18O2、S18O3
C.2 mol SO2与2 mol O2充分反应后放出a kJ的热量
D.该反应达到平衡后,c(SO2)∶c(O2)∶c(SO3)=2∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是:①一个N≡N键断裂的同时,有3个H—H键断裂;②一个N
2NH3已达到平衡状态的是:①一个N≡N键断裂的同时,有3个H—H键断裂;②一个N![]() N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1逆反应速率v(NH3)=0.4 mol·(L·min)-1。
N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1逆反应速率v(NH3)=0.4 mol·(L·min)-1。
A.全部B.①③④⑤C.②③④⑤⑦D.①③⑤⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com