
(6分)请回答下列问题:
(1)在一定温度下,下列叙述是可逆反应A(g)+3B(g)  2C(g)达到平衡的标志的是
2C(g)达到平衡的标志的是
①C的生成速率与C的分解速率相等;
②单位时间生成amol A,同时生成3amol B;
③A、B、C的浓度不再变化;
④A、B、C的分子数目比为1:3:2 ;
⑤混合气体的总压强不再变化;
⑥混合气体的物质的量不再变化;
⑦单位时间消耗amol A,同时生成3amol B;
⑧单位时间内生成a mol C,同时生成 mol B
mol B
(2)在稀氨水中存在下述电离平衡NH3+H2O NH3 ·H2O
NH3 ·H2O NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”、“减小”或“不变”);平衡移动方向如何?(填“正向移动”或“逆向移动”)
NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”、“减小”或“不变”);平衡移动方向如何?(填“正向移动”或“逆向移动”)
加入的物质 | 少量NH4Cl固体 | 少量KOH溶液 |
c(OH-)的变化 | ||
平衡移动方向 |
①、③、⑤、⑥、⑦
(2)加入的物质 少量NH4Cl固体 少量KOH溶液
c(OH-)的变化 减小 增大
平衡移动方向 逆向移动 逆向移动
【解析】
试题分析:(1)①C的生成速率与C的分解速率相等,v正(C)=v逆(C),表示的是正逆反应速率,达到平衡,①正确;②单位时间生成amolA,同时生成3a molB,表示的是逆反应方向,不能证明正逆反应速率相等,不一定达到平衡,故②错误;③A、B、C的浓度不再变化,是化学平衡的特征,达到了平衡,故③正确;④A、B、C的分子数比为1:3:2的状态不一定是化学平衡状态,故④错误.⑤发应是一个前后系数和变化的反应,混合气体的总压强不再变化,达到了平衡,故⑤正确;⑥发应是一个前后系数和变化的反应,当混合气体的总的物质的量不再变化,达到了平衡,故⑥正确;⑦单位时间消耗amol A,同时生成3amol B表示正逆反应速率,且符合计量数之比,⑦正确;单位时间内生成a mol C,同时生成B应该为1.5mol,⑧错误,答案为①、③、⑤、⑥、⑦;(2)氨水中存在NH3+H2O?NH3?H2O?NH4++OH-,向氨水中加入少量硫酸铵,硫酸铵中含量铵根离子,导致溶液中铵根离子浓度增大,抑制氨水电离,平衡向左移动,所以溶液中氢氧根离子浓度减小;向氨水中加入少量氢氧化钾,导致氢氧根离子浓度增大,抑制氨水电离,平衡向逆反应方向移动,故答案为减小;增大;逆向移动;逆向移动
考点:弱电解质的电离平衡


科目:高中化学 来源:2014-2015广东省汕头市高二上学期月考化学(理)试卷(解析版) 题型:选择题
将Mg条、Al条平行插入一定浓度的NaOH溶液中(如图所示连接)。此电池工作时,下列叙述正确的是

A.Mg比Al活泼,失去电子被氧化成Mg2+
B.Al条在反应中逐渐变细
C.该电池的外电路中,电子由Mg极流出,Al极流入
D.消耗24gMg,电路中将转移2mol电子
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市高二上学期期中考试化学(文)试卷(解析版) 题型:选择题
下列说法一定正确的是
A.0.5 mol Cl2所占体积约为11.2 L
B.16 g O2中含有的分子数约为6.02×1023
C.0.1 mol/L NaCl溶液中含溶质的物质的量为0.1 mol
D.标准状况下,11.2 L N2和CO的混合气体所含原子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市高二上学期期中考试化学(文)试卷(解析版) 题型:选择题
食品卫生与人们身体健康密切相关,下列做法符合《食品卫生法》的是
A.用工业用盐腌制咸菜 B.在牛奶中添加尿素
C.用二氧化硫熏制银耳 D.用纯碱发酵面食
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市高二上学期期中考试化学(理)试卷(解析版) 题型:填空题
(6分)已知一定温度和压强下,在起始容积为V L的容器中充入1 mol A和1 mol B,保持恒温恒压下反应:A(g)+B(g)  C(g) △H>0。达到平衡时,C的体积分数为40%。试回答:
C(g) △H>0。达到平衡时,C的体积分数为40%。试回答:
(1)升温时,C的反应速率 (填“加快”、“减慢”或“不变)。
(2)若使温度、压强在上述条件下恒定不变,平衡时在密闭容器中继续充入2 mol A和2 mol B,则反应再次达到平衡时,C的体积分数是
(3)若反应在恒温恒容条件下进行并达到平衡,保持其他条件不变,向容器中通入稀有气体,请在右图中画出通入稀有气体后的正逆反应速率随时间的变化图像,并标出v(正)、v(逆)及其关系。
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市高二上学期期中考试化学(理)试卷(解析版) 题型:选择题
已知:2H2(g) +O2(g) = 2H2O(g) ΔH =-483.6 kJ/mol
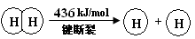

下列说法不正确的是
A.该反应原理可用于设计氢氧燃料电池
B.破坏1 mol H—O 键需要的能量是463.4 kJ
C.H2O(g)=H2(g) + 1/2O2(g) ΔH = +241.8 kJ/mol
D.H2(g) 中的H—H 键比 H2O(g) 中的H—O 键牢固
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市高二上学期期中考试化学(理)试卷(解析版) 题型:选择题
对于可逆反应:A2(g)+3B2(g) 2AB3(g)△H >0下列图象中正确的是
2AB3(g)△H >0下列图象中正确的是


查看答案和解析>>
科目:高中化学 来源:2014-2015内蒙古满洲里市高二上学期第二次月考化学试卷(解析版) 题型:填空题
(12分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K= 。
已知: >
> ,则该反应是 热反应。
,则该反应是 热反应。
(2)图中表示NO2的变化的曲线是 ;用O2表示从0~2 s内该反应的平均速率v= ;

(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省高二1月月考化学试卷(解析版) 题型:选择题
下列离子方程式中,书写正确的是
A.弱酸酸式盐NaHB在水溶液中水【解析】
HB–+H2O H3O++B2–
H3O++B2–
B.电解盐酸:2C1-+2H2O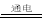 H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C.氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e一=4OH-
D.NaHCO3的电离2:NaHCO3 Na++HCO3-
Na++HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com