
共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是 ( )
A.干冰 B.氯化钠 C.氢氧化钠 D.碘
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列说法正确的是( )
A.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
B.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积约为22.4L
C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA
D.100ml1mol/LAlCl3溶液中含的阳离子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质的应用不正确的是
A.氯化铝是一种电解质,可用于电解法制铝
B.二氧化硅虽然不与强酸反应,但不能用玻璃器皿盛放氢氟酸
C.生石灰能与水反应,可用来干燥氨气
D.液氨汽化时要吸收大量的热,可用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
在20 mL 0.1mol·L-1 NaOH溶液中逐滴加入0.1 mol·L-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是( )
A.溶液酸性时,回滴加入适量的NaOH,溶液中离子浓度可能为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
B.C点时其pH=5.6,溶质恰好为等物质的量CH3COONa和CH3COOH,则溶液中微粒浓度关系为:c(Na+)>c(CH3COO-)
C.在B点,a>20,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
D.在D点:c(CH3COOH)=c(OH-)-c(H+)

查看答案和解析>>
科目:高中化学 来源: 题型:
【化学—选修3 物质结构与性质】
(15分)已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E。又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的。D原子得到一个电子后其3p轨道将全充满。B+离子比D原子形成的离子少一个电子层。C与B可形成BC型的离子化合物。E的原子序数为29。
请回答下列问题:
(1) 元素A简单氢化物中A原子的杂化类型是________,B、C、D的电负性由小到大的顺序为______(用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是____________________。
 (2)E原子的基态电子排布式为________。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如右图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为____________。
(2)E原子的基态电子排布式为________。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如右图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为____________。
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:________。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是________。
(5)温室效应,科学家设计反应:CO2+4H2—→CH4+2H2O以减小空气中CO2。若有1 mol CH4生成,则有________mol σ键和________mol π键断裂。
查看答案和解析>>
科目:高中化学 来源: 题型:
向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,生成的沉淀质量与滴入NaOH溶液体积关系如右图,则原混合溶液中MgCl2与FeCl3的物质的量之比为( )
A. B.
B.

C.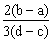 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质:①12C和14C ②CH3(CH2)5CH3和CH3CH=CHCH(CH3)C2H5
③CH3CH2CH2CH3和(CH3)2CHCH3 ④H2、D2、T2 ⑤癸烷和十六烷
|
|
|
⑥O2和O3
A.互为同位素的是(填序号,下同) ;B.互为同系物的是 ;
C.互为同分异构体的是 ; D.为同一种物质的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com