
| A. | 室温下,浓度均为0.1 mol•L-1Na2S2O3和H2SO4溶液,各取5 mL、10 mL的Na2S2O3溶液分别与10 mL的H2SO4溶液混合反应,验证Na2S2O3浓度对反应速率的影响 | |
| B. | 通过测定室温下等浓度的HNO3和H2SO4溶液的pH值,比较元素N、S的非金属性强弱 | |
| C. | KI--I2溶液中存在如下平衡:I2+I-?I3-.取V1mI平衡混合溶液,滴加几滴淀粉,用c mol/L的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),滴定终点时消耗V2 mL的Na2S2O3溶液.根据V1、V2和c可测定上述平衡体系中c(I2) | |
| D. | 确定铝片中氧化铝的含量:取一定质量的铝片,与过量的NaOH溶液充分反应,溢出的气体通过硅胶后,冷却至室温后准确测量其体积 |
分析 A.各取5 mL、10 mL的Na2S2O3溶液,其浓度相同,应选等体积、不同浓度;
B.测定室温下等浓度的HNO3和H2SO4溶液的pH值,均为强酸,但分别为一元酸、二元酸;
C.Na2S2O3与碘发生氧化还原反应,可使平衡I2+I-═I3-逆向移动,由Na2S2O3的物质的量可计算原溶液中n(I2)与n(I3-)之和;
D.只有Al与NaOH反应生成氢气,测定氢气的体积可确定含量.
解答 解:A.各取5 mL、10 mL的Na2S2O3溶液,其浓度相同,应选等体积、不同浓度的Na2S2O3溶液分别与10 mL的H2SO4溶液混合反应,验证Na2S2O3浓度对反应速率的影响,故A错误;
B.测定室温下等浓度的HNO3和H2SO4溶液的pH值,均为强酸,但分别为一元酸、二元酸,则不能比较非金属性,故B错误;
C.碘单质能与I-反应成I3-,并在溶液中建立如下平衡:I2+I-?I3-,I-不能与Na2S2O3发生反应,碘溶液呈紫色,滴定终点溶液变为无色,可不用淀粉作为指示剂,测定的是碘单质和I3-的含量,不能准确测定溶液中的c(I2),故C错误;
D.只有Al与NaOH反应生成氢气,冷却至室温后准确测量其体积,由氢气的体积可计算Al的含量,则可确定铝片中氧化铝的含量,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握反应速率的测定、非金属性比较、化学平衡、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA | |
| B. | 1L0.1mol•L-1NH4Cl溶液中含有的氮原子数小于0.1NA | |
| C. | 用铅蓄电池电解氯化钠溶液,得到标准状况下22.4L氢气时,理论上铅蓄电池中消耗氢离子数目为4NA | |
| D. | 氢气与氯气反应生成标准状况下22.4L氯化氢,断裂化学键的总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
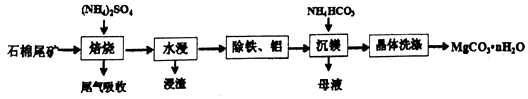
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 27g铝中加入lmol/L的NaOH溶液,转移电子数是3NA | |
| B. | 56gN2与CO混合物中原子总数是4NA | |
| C. | 标准状况下,44.8LNO与22.4LO2反应后的分子数是2NA | |
| D. | 常温下,1LpH=l的H2SO4溶液中的H+为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素符号 | A | B | C | D | E |
| 电负性 | 3.0 | 2.5 | X | 1.5 | 0.9 |
| 原子半径(单位nm) | 0.099 | 0.102 | 0.110 | 0.143 | 0.186 |
| 主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
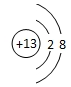 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | X试剂 | 离子方程式 |
| A | K+、Na+、ClO-、SO42- | 少量SO2 | SO2+ClO-+H2O═SO42-+Cl-+2H+ |
| B | NH4+、Fe3+、Br-、SO42- | 过量H2S | 2Fe3++H2S═2Fe2++S↓+2H+ |
| C | NH4+、Na+、Fe3+、[Al(OH)4]- | 过量铜粉 | 2Fe3++Cu═2Fe2++Cu2+ |
| D | K+、Na+、HCO3-、Al3+ | 少量HCl | H++HCO3-═CO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
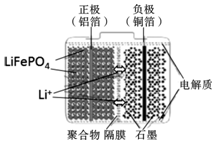 磷酸铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐.电池工作时的总反应为:LiFePO4+6C$?_{放电}^{充电}$ Li1-xFePO4+LixC6,则下列说法正确的是( )
磷酸铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐.电池工作时的总反应为:LiFePO4+6C$?_{放电}^{充电}$ Li1-xFePO4+LixC6,则下列说法正确的是( )| A. | 图中聚合物隔膜是阴离子交换膜 | |
| B. | 充电时,Li+迁移方向是“由右向左” | |
| C. | 放电时,正极的电极反应式为LiFePO4-xe-=Li1-xFePO4+xLi+ | |
| D. | 用该电池电解精炼铜,当转移电子1.25mol时能得到精铜32g,则电子利用率为80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com