

���� ��1����Ȼ��ʯ�ɷ�Ϊ������������
��2����ҵ������Ҫ��Fe2O3������SiO2��A12O3��MgO�����ʣ���úȼ�տ�����CO��SO2���ж����壬�������ֻ�ж������費��Ӧ�����˳�ȥ�������裬Ȼ�����pH��Fe3+��Al3+��ȫת��Ϊ����������������û��ת��Ϊ����������Һ����̼����什���Һ��Fe2+ת��Ϊ̼���������������˵õ�AΪ̼����������Ҫϴ�ӡ����Ȼ����ȵõ���������
��3��Fe3+��ˮ������϶��H+��Fe3++3H2O?Fe��OH��3+3H+������CuO��H+��Ӧ����Cu2+��H2O��������H+Ũ�ȣ�ʹ��ˮ��ƽ�������ƶ�������Fe��OH��3������CuO�ٽ�������ˮ�⣻
��4������������[Fe��CN��6]4-��Ӧ����Fe4[Fe��CN��6]3������
������ֽ������֤��ʳƷ�к���CN-��Fe2+��CN-�������[Fe��CN��6]4-��Fe2+��������O2��������Fe3+��[Fe��CN��6]4- ��Fe3+��Ӧ������³ʿ��ʹ��ֽ����ɫ��
��� �⣺��1���Ŵ��й��Ĵ���֮һ��˾��������Ȼ��ʯ�Ƴɵģ������ɷ���Ҫ��������������
�ʴ�Ϊ��c��
��2�����ɷ�����֪������ԭ���ա��в������ж����������CO��SO2�ȣ�
�ʴ�Ϊ��CO��SO2�ȣ�
�ڳ���ʱKsp[Al��OH��3]=1.0��10-32����ʱ�����Ͻ�Al3+������ȫ��c��OH-��=$\root{3}{\frac{1.0��1{0}^{-32}}{1{0}^{-5}}}$=10-9����c��H+��=$\frac{1{0}^{-14}}{1{0}^{-9}}$mol/L=10-5mol/L��pH=5��
�ʴ�Ϊ��5��
������FeCO3�����ӷ���ʽ�ǣ�Fe2++2HCO3-=FeCO3��+CO2��+H2O��
�ʴ�Ϊ��Fe2++2HCO3-=FeCO3��+CO2��+H2O��
��3����ΪFe3+��ˮ������϶��H+��Fe3++3H2O?Fe��OH��3+3H+������CuO��H+��Ӧ����Cu2+��H2O��������H+Ũ�ȣ�ʹ��ˮ��ƽ�������ƶ�������Fe��OH��3������
�ʴ�Ϊ��Fe��OH��3��Fe3++3H2O?Fe��OH��3+3H+������CuO��H+��Ӧ����Cu2+��H2O��������H+Ũ�ȣ�ʹ��ˮ��ƽ�������ƶ�������Fe��OH��3������
��4���ٸ��ֽⷴӦii�����ӷ���ʽΪ��3[Fe��CN��6]4-+4Fe3+=Fe4[Fe��CN��6]3����
�ʴ�Ϊ��3[Fe��CN��6]4-+4Fe3+=Fe4[Fe��CN��6]3����
�ڻ�����³ʿ���ϳ�ԭ���ɼ��ʳƷ��CN-�����������£�Fe2+��CN-�������[Fe��CN��6]4-��Fe2+��������O2��������Fe3+��[Fe��CN��6]4- ��Fe3+��Ӧ������³ʿ��ʹ��ֽ����ɫ��
�ʴ�Ϊ�����������£�Fe2+��CN-�������[Fe��CN��6]4-��Fe2+��������O2��������Fe3+��[Fe��CN��6]4-��Fe3+��Ӧ������³ʿ��ʹ��ֽ����ɫ��
���� ���⿼�����ʵ��Ʊ�ʵ�鼰�����ķ�����ᴿ��Ϊ��Ƶ���㣬��������ͼ��ÿһ�������ķ�Ӧ�����������ǽⱾ��ؼ���ע���������Ϣ��𣬲��ط�����ʵ�������Ŀ��飬��Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͭƬ����Ƭ��FeCl3��Һ��ɵ�ԭ��� | |
| B�� | ʯī����Ƭ��FeCl3��Һ��ɵ�ԭ��� | |
| C�� | þƬ��пƬ��Fe2��SO4��3��Һ��ɵ�ԭ��� | |
| D�� | ��Ƭ����Ƭ��Fe��NO3��3��Һ��ɵ�ԭ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ��Ŀ�� | ʵ����� | |
| A | �Ʊ�Fe��OH��3���� | ��NaOHŨ��Һ�μӵ�����FeCl3��Һ�� |
| B | �����Ȼ�����Һ | ���Ȼ����ܽ��ڽ�Ũ���������ټ�ˮϡ�� |
| C | ȷ��Na2SO3��Ʒ�Ƿֱ����� | ȡ�����Թ��У�����ϡ�����ữ���ٵμ�BaCl2��Һ���۲��Ƿ��а�ɫ�������� |
| D | �����Ҵ�������ȥ��Ӧ���� ��ϩ | �����ɵ�����ֱ��ͨ��ʢ�����Ը��������Һ���Լ�ƿ���۲���Һ�Ƿ���ɫ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1mol/L��Na2CO3��Һ�У�c��CO32-���T2c��HCO3-��+c��H+��-c��OH-�� | |
| B�� | ���ʵ���Ũ��֮��Ϊ1��2��NaClO��NaHCO3�����Һ�У�c��HClO��+c��ClO-��=2c��HCO3-��+2c��CO32-��+2c��H2CO3�� | |
| C�� | ��3.0L0.1mol/LNaOH��Һ�л���ͨ��CO2����Һ����8.8gʱ����Һ�У�c��Na+����c��CO32-����c��HCO3-����c��OH-����c��H+�� | |
| D�� | �����ʵ�����CH3COOH��CH3COONa�����ҺPH=4.75�У�c��CH3COO-��+c��OH-����c��CH3COOH��+c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
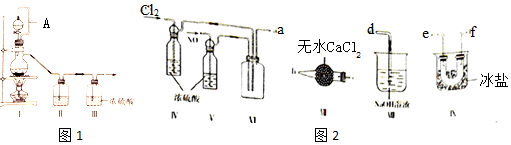
| װ�â� | װ�â� | ||
| ��ƿ�� | ��Һ©���� | ||
| �Ʊ�����Cl2 | MnO2 | �� | �� |
| �Ʊ�����NO | Cu | �� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ڿ�����ȼ�� | B�� | �����������ڹ����·�Ӧ | ||
| C�� | þ�ڿ�������ʧȥ���� | D�� | ��������ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaOH | B�� | KMnO4 | C�� | KSCN | D�� | ����KI |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH=1����Һ�У�NH4+��K+��ClO-��Cl- | |
| B�� | ʹ��̪���ɫ����Һ�У�Na+��Na+��SO32-��NO3- | |
| C�� | �����������Ӧ������������Һ�У�NH4+��Al3+��NO3-��Cl- | |
| D�� | ��ɫ������Һ�У�K+��Cu2+��Cl-��NO3- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com