
| 2mol |
| aV×10-3mol |
| 5mol |
| 0.025×Cmol |
| aV |
| 10 |
| 1mol |
| 0.1aV×0.1 |
| 18xg |
| w-0.1aV×0.1×90 |
| 50m-45aV |
| 9aV |
| aV |
| 10 |
| 50m-45aV |
| 9aV |


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:
| A、S8转化为S6、S4、S2属于物理变化 |
| B、不论哪种硫分子,完全燃烧时都生成SO2 |
| C、S8、S6、S4、S2均属于共价化合物 |
| D、把硫单质在空气中加热到750℃即得S2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物理性质 | 易溶于水,不溶于乙醇;熔点 48.2℃;在潮湿的空气中易潮解 |
| 化学性质 | 43℃以上的空气中易风化;遇酸易分解 (S2O32-+2H+=S↓+SO2↑+H2O ) |
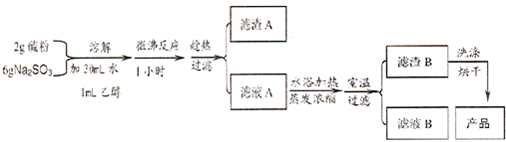
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
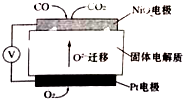 汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO,它们是现代化城市中的大气污染物.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)
汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO,它们是现代化城市中的大气污染物.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4mol?L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/×10-3mol?L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:
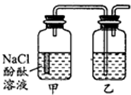 某课外活动小组,将剪下的一块镀锌铁放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是( )
某课外活动小组,将剪下的一块镀锌铁放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是( )| A、乙中导气管里形成一段水柱 |
| B、乙中导气管中产生气泡 |
| C、金属片剪口处溶液变红 |
| D、锌被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
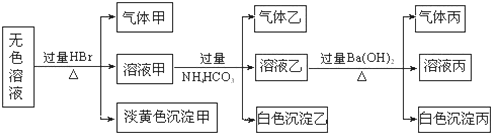
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com