
分析 I.(1)H2A在溶液中部分电离属于弱酸,HA-的水解程度与电离程度关系不确定;
(2)A.Kw与温度有关;
B.根据电荷守恒分析;
C.HA-的水解程度与电离程度关系不确定;
D.根据物料守恒分析;
(3)①降低温度,抑制难溶物的电离,导致溶度积常数变小;
②加盐酸,促进难溶盐的电离,使平衡向正反应方向移动;
③根据Ksp=c(Ca2+)×c(A2-)以及钙离子的浓度计算;
II.(1)根据外界条件对平衡的影响来确定平衡移动方向,从而确定离子浓度大小和溶液颜色变化;
(2)根据氧化还原反应中得失电子守恒来计算;
(3)根据溶度积常数以及水的离子积常数来进行计算.
解答 解:I.(1)H2A在溶液中部分电离属于弱酸,HA-的水解程度与电离程度关系不确定,所以NaHA溶液的酸碱性不能确定;
故答案为:无法确定;
(2)A.Kw与温度有关,温度不知道,所以c(H+)•c(OH-)的值不确定,故A错误;
B.溶液中电荷守恒为:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),故B错误;
C.HA-的水解程度与电离程度关系不确定,c(A2-)与c(H2A)的大小关系不确定,故C错误;
D.0.1mol/L的NaHA溶液中,物料守恒为:c(Na+)=c(HA-)+c(A2-)+c(H2A),故D正确;
故答案为:D;
(3)①降低温度,抑制难溶物的电离,所以导致溶度积常数变小.
故答案为:减小.
②加盐酸,促进难溶盐的电离,使平衡向正反应方向移动,所以钙离子浓度增大.
故答案为:增大;
③已知溶液中c(Ca2+)=0.1mol/L,Ksp=c(Ca2+)×c(A2-)=2.0×10-11,则c(A2-)=$\frac{2×1{0}^{-11}}{0.1}$mol/L=2.0×10-10mol/L,
故答案为:2.0×10-10;
II(1)c(H+)增大,平衡2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O右移,溶液呈橙色,
故答案为:橙;
(2)根据电子得失守恒:n(Cr2O72-)×6=n(FeSO4•7H2O)×1,n(FeSO4•7H2O)=$\frac{1mol×6}{1}$=6mol,
故答案为:6;
(3)当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$=10-9 mol/L,c(H+)═$\frac{1{0}^{-14}}{1{0}^{-9}}$=10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5;
故答案为:5.
点评 本题考查了盐溶液酸碱性的判断、溶液中离子浓度的关系、难溶物溶解平衡及其计算,题目难度中等,注意掌握判断溶液中离子浓度大小的常用方法,明确电荷守恒、物料守恒的含义及有关难溶物溶度积计算方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
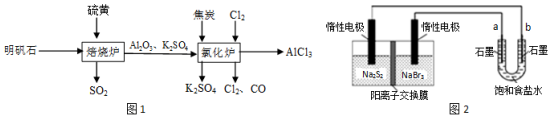
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
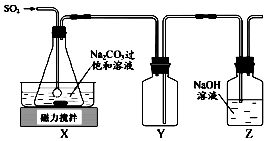 焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时均易分解.实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如图所示.
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时均易分解.实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 通入氯气后的溶液中一定不存在I- | |
| B. | 通入氯气之后原溶液中的Fe2+全部被氧化 | |
| C. | 原溶液中的Br-不可能被氧化 | |
| D. | 若取少量所得溶液,再加入CCl4溶液充分振荡,静置、分液,下层溶液可能呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com