
| V |
| Vm |
. |
| M |
| m总 |
| n总 |
| ||
| ||
| 1 |
| 2 |
| ||
| ||
| 11.2L |
| 22.4L/mol |
| 7.2g |
| 0.5mol |
| ||
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| ||


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
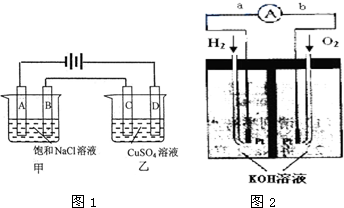 电解原理在化学工业上有着广泛的应用,按图1所示所示装置进行电解实验.A、B、C、D均为惰性电极,开始电解前在甲装置的A、B极两侧各滴入酚酞试液.工作一段时间后:
电解原理在化学工业上有着广泛的应用,按图1所示所示装置进行电解实验.A、B、C、D均为惰性电极,开始电解前在甲装置的A、B极两侧各滴入酚酞试液.工作一段时间后:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高温 高压 |
| B、低温 低压 |
| C、高温 低压 |
| D、高压 低温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl[HCl] |
| B、AgNO3[Ag2O] |
| C、CuCl2[CuSO4] |
| D、CuSO4[CuO] |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、盐酸的体积为80mL |
| B、a的取值范围为0<a<50 |
| C、n(Mg2+)≥0.025mol |
| D、当a值为30时,b值为0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.50 | B、4.00 |
| C、7.50 | D、3.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com