
| A. | FeCl3溶液可作外伤止血剂,其原理与胶体知识有关 | |
| B. | C单质可在高温下被浓H2SO4和浓HNO3氧化,而Si 单质不与任何酸反应 | |
| C. | SiO2 分子的空间构型为四面体空间网状结构,因此SiO2晶体硬度大,熔沸点高 | |
| D. | 标准状况下,22.4LSO2和SO3的混合物所含分子数为NA |
科目:高中化学 来源: 题型:解答题
 ,电子占据的最高能层具有的原子轨道数为16.
,电子占据的最高能层具有的原子轨道数为16.| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | 其一种同位素,可被用作相对原子质量的标准 |
| Y | 其最高价氧化物对应水化物能与其气态氢化物相互间发生化合反应 |
| P | 是短周期中(除稀有气体外)原子半径最大的元素 |
| Q | 存在质量数为25,中子数为13的核素 |
| W | 位于周期表第13列 |
| R | 与Z同族,且最高价氧化物对应水化物的浓溶液常温下与W单质会出现钝化现象 |
| 化合物 | X3Y4 | R2T2 |
| 晶体类型 | ||
| 熔点/℃ | >3600 | -76 |
 ,用化学方程式表示P2R溶液在空气中的变质过程4Na2S+O2+2H2O═4NaOH+2Na2S2.
,用化学方程式表示P2R溶液在空气中的变质过程4Na2S+O2+2H2O═4NaOH+2Na2S2.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.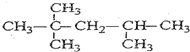 .
.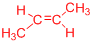 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥⑦ | B. | ④⑤⑦ | C. | ④⑤ | D. | ③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质中至少含有四种元素 | |
| B. | 用饱和的CuSO4溶液使蛋清液发生盐析,进而分离、提纯蛋白质 | |
| C. | 所有的糖类、油脂和蛋白质均能发生水解反应 | |
| D. | 油脂在稀硫酸催化条件下的水解又叫皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③⑤②④ | C. | ②⑤①③④ | D. | ②①③⑤④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
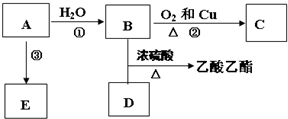
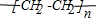 ,E不能(填“能”或“不能”)使酸性KMnO4溶液褪色.
,E不能(填“能”或“不能”)使酸性KMnO4溶液褪色.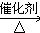 2CH3CHO+2H2O,反应类型氧化反应;B+DCH3COOH+C2H5OH
2CH3CHO+2H2O,反应类型氧化反应;B+DCH3COOH+C2H5OH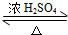 CH3COOC2H5+H2O,反应类型酯化(或取代)反应.
CH3COOC2H5+H2O,反应类型酯化(或取代)反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com