
| 浓硫酸 |
| 170°C |


科目:高中化学 来源: 题型:阅读理解
 加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.某学生在实验室测定食用精制盐是否含碘及测定含碘量,主要反映为:
加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.某学生在实验室测定食用精制盐是否含碘及测定含碘量,主要反映为:查看答案和解析>>
科目:高中化学 来源: 题型:
(1)右图所示是实验室中制取气体的一种简易装置。

①请简述检验它的气密性的方法 。
②利用右图所示装置可以制取 气体(填反应物状况及发生反应是否需要的条件)。
(2)张明同学设计下图所示装置,用粗铁粒与189g·L-1硝酸反应制取NO气体。请回答有关问题。

①189g·L-1硝酸的物质的量浓度为 。
②NO气体能用排水法收集,而不能用排空气法收集的可能原因是 。
③当找末止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是 。B装置烧杯中液体的作用是 。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
④该实验中,若去掉B装置,对实验结果是否有影响? 。
⑤将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量是 (用含a和b的代数式表示)。
⑥完全反应后,A装置烧杯里含铁的价态可能是 。现有仪器和药品:试管和胶头滴管。0.1mol·L-1KSCN溶液、0.1mol·L-1KI溶液、0.2mol·L-1酸性KMnO4溶液、氯水等。请你设计一个简单实验,探究上述判断,填写下列实验报告:
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液 | |
| 第二步 | 若溶液紫色退去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
(17分)
(1)右图所示是实验室中制取气体的一种简易装置。
①请简述检验它的气密性的方法 。
②利用右图所示装置可以制取 气体(填反应物状况及发生反应是否需要的条件)。
(2)张明同学设计下图所示装置,用粗铁粒与189g·L-1硝酸反应制取NO气体。请回答有关问题。
①189g·L-1硝酸的物质的量浓度为 。
②NO气体能用排水法收集,而不能用排空气法收集的可能原因是 。
③当找末止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是 。B装置烧杯中液体的作用是 。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
④该实验中,若去掉B装置,对实验结果是否有影响? 。
⑤将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量是 (用含a和b的代数式表示)。
⑥完全反应后,A装置烧杯里含铁的价态可能是 。现有仪器和药品:试管和胶头滴管。0.1mol·L-1KSCN溶液、0.1mol·L-1KI溶液、0.2mol·L-1酸性KMnO4溶液、氯水等。请你设计一个简单实验,探究上述判断,填写下列实验报告:
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液 |
|
| 第二步 |
| 若溶液紫色退去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省四地六校高三第一次月考化学试卷(解析版) 题型:填空题
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中发生了氧化还原反应的是( )

(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。

试写出有水参加、水为还原剂且为类型Ⅳ的一个化学方程式:_ _
(3)NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2的反应离子方程式是
MnO4-+
NO2-+  =====
Mn2++ NO3-+ H2O
=====
Mn2++ NO3-+ H2O
Ⅰ、请补充完整,配平方程式并标出电子转移方向和数目
Ⅱ、某同学称取了7.9 g KMnO4固体,欲配制100 mL溶液。回答下列问题:
该实验中,使用容量瓶时要检查是否漏水,其操作是: 。
Ⅲ、不规范的实验操作会导致实验结果的误差。分析下列操作对实验结果的影响偏小 (请填序号):
①在溶解过程中有少量液体溅出烧杯外
②定容时仰视仪器上的刻度线
③定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
IV、最后所得的溶液应存放在试剂瓶中,并贴上标签,请你填写该标签(如图)。

V、某同学用上述配好的KMnO4溶液滴定末知浓度的NaNO2溶液:
取20mL末知浓度的NaNO2溶液于锥形瓶;
取上述配好的KMnO4溶液于 (“酸式”或“碱式”)滴定管
滴定完成后消耗KMnO4溶液10mL则NaNO2溶液的浓度为
|
查看答案和解析>>
科目:高中化学 来源:山东省枣庄市2010届高三年级调研考试理综(化学部分)试题 题型:实验题
(17分)
(1)右图所示是实验室中制取气体的一种简易装置。
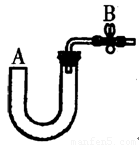
①请简述检验它的气密性的方法 。
②利用右图所示装置可以制取 气体(填反应物状况及发生反应是否需要的条件)。
(2)张明同学设计下图所示装置,用粗铁粒与189g·L-1硝酸反应制取NO气体。请回答有关问题。

①189g·L-1硝酸的物质的量浓度为 。
②NO气体能用排水法收集,而不能用排空气法收集的可能原因是 。
③当找末止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是 。B装置烧杯中液体的作用是 。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
④该实验中,若去掉B装置,对实验结果是否有影响? 。
⑤将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量是 (用含a和b的代数式表示)。
⑥完全反应后,A装置烧杯里含铁的价态可能是 。现有仪器和药品:试管和胶头滴管。0.1mol·L-1KSCN溶液、0.1mol·L-1KI溶液、0.2mol·L-1酸性KMnO4溶液、氯水等。请你设计一个简单实验,探究上述判断,填写下列实验报告:
|
实验步骤 |
操作 |
现象与结论 |
|
第一步 |
取少量液体装于试管,向试管中滴入几滴KSCN溶液 |
|
|
第二步 |
|
若溶液紫色退去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com