
下列实验设计能够成功的是
| 实验目的 | 实验步骤及现象 | |
| A | 检验亚硫酸钠试样是否变质 | 试样 |
| B | 检验淀粉是否水解 | 试样 |
| C | 证明酸性条件下H2O2氧化性比I2强 | NaI溶液 |
| D | 除去氯化钠晶体中少量硝酸钾 | 试样 |
科目:高中化学 来源: 题型:
下列关于纸色谱法分离Fe3+和Cu2+操作正确的是( )
A.裁滤纸应垂直纤维方向裁开
B.点样时,斑点尽量小,且再点时必须在同一位置
C.展开时,用流动相溶剂刚好淹过色斑进行展开
D.当流动相溶剂上升至滤纸上沿时,取出晾干观察
查看答案和解析>>
科目:高中化学 来源: 题型:
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。

下列说法错误的是 ( )
A.步骤(1)需要过滤装置
B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚
D.步骤(4)需要蒸馏装置
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组探究铁粉与水蒸气反应后的固体的组成,铁粉与水蒸气反 应的化学方程式为______________________________________________。
应的化学方程式为______________________________________________。
基于上述反应所得黑色固体粉末,研究性学习小组提出下列假设并欲做实验分析。
假设一:固体全部是Fe3O4
假设二:固体全部是Fe
假设三:固体是____________________
取铁粉与水蒸气反应后的固体作为样品,进行如下实验探究。
探究1:取少量样品投入硫酸铜稀溶液中,若现象为___________________________
____________________________________________________,则假设一成立。
探究2:取1.68 g样品在纯氧中灼烧后,若质量为_____ _________________________ g,
_________________________ g,
则假设二成立。
经过实验探究,假设一、二都不成立。
探究3:取样品4.00 g进行如下实验。
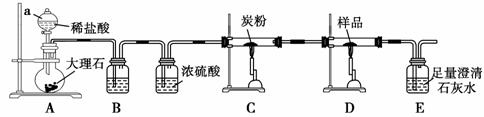
B中的溶液是____________________________;实验后经测定样品完全反应,D中剩余固体质量为3.36 g,且测得E中沉淀质量为6.0 g,则样品中Fe3O4的质量分数为________;实验装置中有一明显缺陷是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下进行性质比较的实验设计,不合理的是
A.比较镁、铝金属性:镁、铝(除氧化膜)分别放入4 mol·L-1NaOH溶液中
B.比较氯、溴非金属性:氯气通入溴化钠溶液中
C.比较Cu、Fe2+的还原性:Cu加入FeCl3溶液中
D.比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.Ksp只与难溶电解质的性质和温度有关
B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀
C.其他条件不变,离子浓度改变时,Ksp不变
D.两种难溶电解质作比较时,Ksp小的,溶解度一定小
查看答案和解析>>
科目:高中化学 来源: 题型:
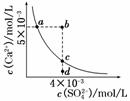 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
( )
A.在任何溶液中,c(Ca2+)、c(SO )均相等
)均相等
B.b点将有沉淀生成,平衡后溶液中c(SO )一定等于3×10-3 mol/L
)一定等于3×10-3 mol/L
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化合物中,含有非极性共价键的离子化合物是( )
A.CaC2 B.N2H4
C.Na2S2 D.NH4NO3
Ⅱ.[2013·海南卷] (14分)
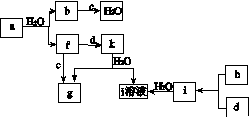
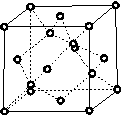
图(a)所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸。a的一种同素异形体的晶胞如图(b)所示。
(a)
(b)
回答下列问题:
(1)图(b)对应的物质名称是________,其晶胞中的原子数为________,晶体的类型为________。
(2)d中元素的原子核外电子排布式为____________。
(3)图(a)中由二种元素组成的物质中,沸点最高的是________,原因是____________________,该物质的分子构型为________,中心原子的杂化轨道类型为________。
(4)图(a)中的双原子分子中,极性最大的分子是________。
(5)k的分子式为________,中心原子的杂化轨道类型为________,属于________分子(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下:
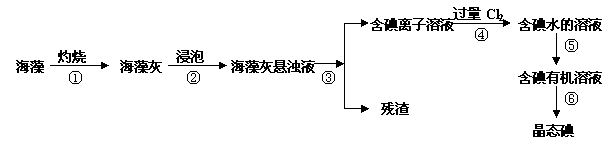
(1)指出上述提取碘的过程中有关实验操作的名称:
步骤③ ,步骤⑤ 。
(2)写出步骤④对应反应的离子方程式: 。
(3)提取碘的过程中,可供选择的有机试剂是 。(填编号)
A.酒精 B.醋酸 C.四氯化碳 D.苯
(4)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网、以及必要的夹持仪器和物品,尚缺少的玻璃仪器是 。
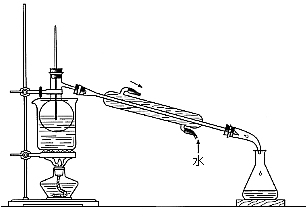
(5)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图实验装置中存在的错误之处: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com