
| A. | 1mol蔗糖完全水解生成葡萄糖分子数为2 NA | |
| B. | 在氢氧碱性燃料电池中,若正极消耗22.4L气体(标准状况),则转移电子数为2NA | |
| C. | 16.0 gCuO和Cu2S的混合物含阴离子数为0.2NA | |
| D. | 2.24L(标准状况)一氯甲烷分子中含共价键数为0.4NA |
分析 A.1分子蔗糖水解生成1分子葡萄糖和1分子果糖;
B.氢氧燃料电池中正极通入的是氧气,标况下22.4L氧气的物质的量为1mol,完全反应得到4mol电子;
C.CuO和Cu2S的化学式中都含有1个阴离子,但二者摩尔质量不同,无法计算含有阴离子数目;
D.一氯甲烷分子中含有4个共价键,根据n=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$计算含有共价键数目.
解答 解:A.1mol蔗糖完全水解生成1mol葡萄糖和1mol果糖,水解生成葡萄糖的分子数为NA,故A错误;
B.在氢氧碱性燃料电池中,正极通入的是氧气,若正极消耗标况下22.4L气体(1mol),转移了4mol电子,转移电子数为4NA,故B错误;
C.CuO和Cu2S的化学式中都含有1个阴离子,由于二者摩尔质量不同,无法计算16.0 gCuO和Cu2S的物质的量,则无法计算混合物中含有阴离子数目,故C错误;
D.标况下2.24L一氯甲烷的物质的量为0.1mol,0.1mol一氯甲烷分子中含有0.4mol共价键,含共价键数为0.4NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且甲、乙、丙均为10电子的分子.Y、Z结合生成化合物丁.有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如图,下列说法正确的是( )
现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且甲、乙、丙均为10电子的分子.Y、Z结合生成化合物丁.有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如图,下列说法正确的是( )| A. | 原子半径的大小:W<Y<Z<X | B. | 单质与H2化合的难易程度:X>Y | ||
| C. | 甲与丙反应不可能生成离子化合物 | D. | Z的最高价氧化物的水化物为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 可以发生氧化反应 | B. | 分子式为C9H10O | ||
| C. | 分子中所有原子都处于同一平面上 | D. | 能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的NH4HSO4溶液:Ba2+、Na+、NO3-、Cl- | |
| B. | 通KSCN溶液变红色的溶液:NH4+、Al3+、SO42-、Cl- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液:Ca2+、Na+、ClO-、NO3- | |
| D. | 与铝反应产生大量氢气的溶液:K+、Na+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 |  | 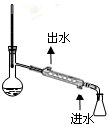 |  |
| A.吸收氨气 | B.中和热的测定 | C.分离溴苯和苯的混合物 | D.除去SO2气体中的HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题



查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z |
| A. | Y的单质与水反应时,Y的单质既是氧化剂又是还原剂 | |
| B. | X的最高价氧化物对应的水化物与其气态氢化物可以反应生成盐 | |
| C. | X、Y、Z元素形成的单质,常温下Z单质的沸点最底 | |
| D. | X的氢化物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,5.6g金属铁投入足量的浓硫酸中,电子转移数为0.3NA | |
| B. | 18g D2O所含的中子数为10NA | |
| C. | 标准状况下,8 gSO3所含原子数为0.4NA | |
| D. | 常温下,1.0LpH=13的Ba (OH) 2溶液中含有的OH-数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com