
| [H+][A2-] |
| [HA-] |
| [H+][A2-] |
| [HA-] |


科目:高中化学 来源: 题型:
| A、手机上用的锂离子电池属于二次电池 |
| B、废旧电池应集中回收并填埋处理 |
| C、甲醇燃料电池可把化学能转化为电能 |
| D、锌锰干电池中,锌电极是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:



 )在一定条件下也能进行缩聚,写出在催化剂作用下水杨酸缩聚的化学方程式
)在一定条件下也能进行缩聚,写出在催化剂作用下水杨酸缩聚的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
 铬化学丰富多彩,由于铬光泽度好,常将铬镀在其它金属表面,同铁、镍组合各种性能的不锈钢.K2Cr2O7和CrO3大量用于鞣革、印染、颜料、电镀等工业中,是工业上造成铬污染的主要原因.近期曝光的“毒胶囊”事件中,就是因为工业皮革的下角料或破皮鞋等为原料制成的工业明胶被冒充成食用明胶制成胶囊,造成胶囊内的铬严重超标.
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其它金属表面,同铁、镍组合各种性能的不锈钢.K2Cr2O7和CrO3大量用于鞣革、印染、颜料、电镀等工业中,是工业上造成铬污染的主要原因.近期曝光的“毒胶囊”事件中,就是因为工业皮革的下角料或破皮鞋等为原料制成的工业明胶被冒充成食用明胶制成胶囊,造成胶囊内的铬严重超标.查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 催化剂 |
| 温度CO2% n(H2)/n(CO2) | 500K | 600K | 700K | 800K |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
| n(H2) |
| n(CO2) |
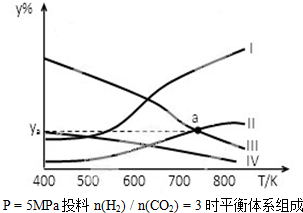 ①表示CH3CH2OH体积分数曲线的是
①表示CH3CH2OH体积分数曲线的是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,56g Fe与足量的盐酸完全反应转移的电子数为3NA |
| B、标准状态下,54g H2O中含有分子数为3NA个 |
| C、0.1mol?L-1的硫酸铝溶液所含的SO42-数就是0.3NA |
| D、NA个He分子所具有的体积为22.4L? |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示装置中,能观察到电流计指针偏转,M棒变粗,N棒变细,由此判断表中所列M、N、P物质,其中合理的是( )
如图所示装置中,能观察到电流计指针偏转,M棒变粗,N棒变细,由此判断表中所列M、N、P物质,其中合理的是( )| M | N | P | |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 铁 | 稀盐酸 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 锌 | 铜 | 硫酸铜溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com