
【题目】A~G是几种烃的分子球棍模型(如图),据此回答下列问题:
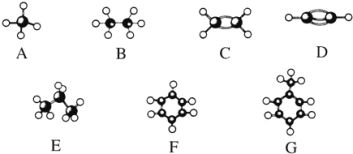
(1)E的一氯取代物同分异构有_______种。
(2)一卤代物种类最多的是________。(请填字母,下同)
(3)能够与Br2发生加成反应的两种气态烃是________。
(4)能够与酸性高锰酸钾反应的烃是________。
科目:高中化学 来源: 题型:
【题目】乙酰苯胺是一种具有退热镇痛作用的药物,可用苯胺和冰醋酸为原料来制备乙酰苯胺。
①化学原理为: (已知:苯胺易被氧化)
(已知:苯胺易被氧化)
②相关物质的物理常数
物质 | 相对分子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度(g) | |
水 | 乙醇 | |||||
苯胺 | 93 | 无色液体 | 6 | 184 | 3.42(20℃) | 任意比混溶 |
冰醋酸 | 60 | 无色液体 | 17 | 118 | 任意比混溶 | 任意比混溶 |
乙酰苯胺 | 135 | 白色片状固体 | 114 | 304 | 0.56(20℃)、3.45(50℃)、5.20(100℃) | 36.9(20℃) |
③制各乙酰苯胺的装置如图所示:韦氏分馏柱作用与原理类似于冷凝管。
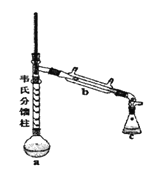
④制备方法和过程:

(1)仪器a的名称_______。
(2)制备过程中加入锌粒的作用:其一是________、其二是防止暴沸。
(3)从化学平衡的角度分析,步骤1要控制分馏柱上端的温度在105℃左右的原因_____。
(4)步骤2
(5)步骤3中洗涤剂最好选择________。
A.冷水 B.热水 C.15%的乙醇溶液 D.NaOH溶液
(6)步骤4重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→_____→冷却结晶→过滤→洗涤→干燥。
(7)本实验所得到的乙酰苯胺产率是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(配制KMnO4标准溶液)如图是配制50 mL KMnO4标准溶液的过程示意图。
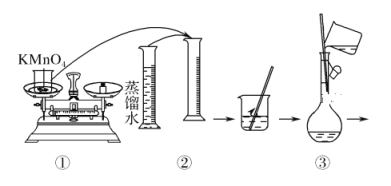
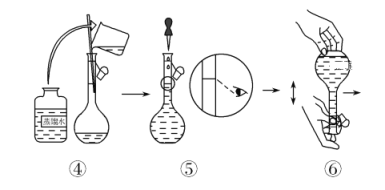
(1)请你观察图示判断,其中不正确的操作有(填序号)________。
(2)其中确定50 mL溶液体积的容器是(填名称)________。
(3)如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)已知草酸跟KMnO4溶液反应的离子方程式为:
2MnO4-+5H2C2O4+6H+===2Mnx++10CO2↑+8H2O则方程式中的x=________。
(5)经过计算,血液样品中Ca2+的浓度为________mg/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宁夏的硒砂瓜现今已享誉区内外,西瓜富含硒元素,有延年益寿、抗衰老、抗癌作用,因之得名“硒砂瓜”。二氧化硒(Se)是一种氧化剂,其被还原后的单质硒,可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。在回收过程当中涉及到如下两个化学反应:①SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O;②Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O。下列有关叙述正确的是
A.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2
B.①中Se是氧化产物,I2是还原产物
C.反应②中方框中的物质为还原产物
D.反应①中每有0.6mol I2生成,转移电子数目为2.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物既是可导致酸雨的物质,也是造成空气污染的重要物质,加大对氮的氧化物的治理是环境保护重要举措。
(1)在一定条件下氨气可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式: _____________________________,该反应中氧化剂是_________,还原剂是________________________________________。
(2)汽车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成对大气无污染的气体,该反应的化学方程式为___________________________________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
现有VL某NaOH溶液能完全吸收nmol NO2和mmol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为_________ mol·L-1。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=_________。
③用含n和m的代数式表示所得溶液中NO3-和NO2-浓度的比值c(NO3-)∶c(NO2-)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )

选项 | 气体 | a | b | c | d |
A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO溶液 | 浓硫酸 |
B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
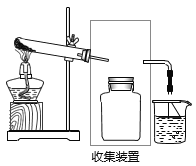
【题目】实验室用如图所示装置进行氨气实验。
(1)实验室常用 NH4Cl 与Ca(OH)2 制取氨气,该反应的化学方程式为______。
(2)若要收集一瓶氨气,请将下列甲装置补充完整,在虚框内画出连接图______。
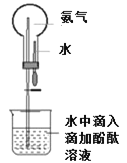
(3)用如图装置做喷泉实验。轻轻挤压滴管,使少量水进入烧瓶,打开止水夹,观察现象, 解释产生这一现象的原因______。
(4)如图为合成氨催化氧化制硝酸的流程示意图:
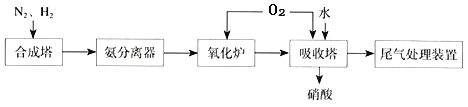
①合成塔中化学方程式为______。
②氧化炉中的化学方程式______。
③吸收塔 NO2![]() HNO3 氧化剂与还原剂物质的量之比为______。
HNO3 氧化剂与还原剂物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
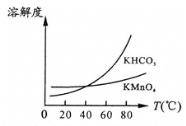
【题目】高锰酸钾常用作消毒杀菌、水质净化剂等。某小组用软锰矿(主要含MnO2,还含有少量SiO2、Al2O3、Fe2O3等杂质)模拟工业制高锰酸钾流程如下。试回答下列问题。
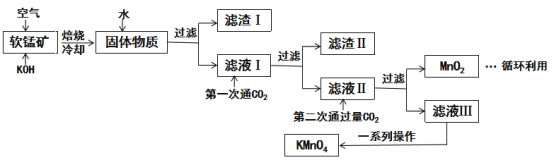
(1)焙烧过程中发生的主要反应为MnO2+KOH+O2![]() K2MnO4+H2O,该反应配平后MnO2与O2的化学计量数比为________。采用对空气加压的方法可以提高MnO2的利用率,原因是_________________。
K2MnO4+H2O,该反应配平后MnO2与O2的化学计量数比为________。采用对空气加压的方法可以提高MnO2的利用率,原因是_________________。
(2)滤渣Ⅱ是________,第一次通CO2不能用稀硫酸代替的原因是_____________。
(3)第二次通入过量的CO2生成MnO2的离子方程式为___________________。
(4)由图可知,从滤液Ⅲ得到KMnO4需经过__________________、洗涤等操作。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.利用化学反应将储存在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产、生活提供能量。
(1)甲同学认为,所有的氧化还原反应都可以设计成原电池,你是否同意?____ (填“是”或“否”)。
(2)乙同学依据氧化还原反应:2Ag++Cu=Cu2++2Ag设计的原电池如图所示:
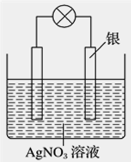
①负极材料是_______,发生的电极反应为____________________________。
②当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4 g,则该原电池反应共转移的电子数目是________。
II.水是生命之源,也是化学反应中的主角。请回答下列问题:
(1)已知:2 mol H2完全燃烧生成液态水时放出572 kJ的热量。
①若2 mol氢气完全燃烧生成水蒸气,则放出的热量________ (填“>”“<”或“=”)572 kJ。
②每克氢气燃烧生成液态水时放出的热量为________。
(2)天然气(主要成分CH4)和氧气反应生成二氧化碳和水,该反应为放热的氧化还原反应,可将其设计成燃料电池,构造如图所示,a、b两个电极均由多孔的碳块组成。a电极的电极反应式是____________________________。当a极转移0.3mol电子时,b极消耗标准状况下O2的体积为_________________mL。b极附近pH____(填“增大”、“减小”或“不变”)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com