
T1��ʱ�����ݻ�Ϊ2 L���ܱ������г���һ������A�����B���壬�������·�Ӧ��
A(g)��2B(g) C(g)
C(g)
��Ӧ�����вⶨ�IJ������ݼ��±���
| ��Ӧʱ��/min | n(A)/mol | n(B)/ mol |
| 0 | 1.00 | 1.20 |
| 10 | 0.50 | |
| 30 | | 0.20 |
B
�������������A���ɱ���ʱ���֪��10s��A��Ũ�ȱ仯��Ϊ1mol-0.5mol=0.5mol���ɷ���ʽ��֪C��Ũ�ȱ仯��Ϊ0.5mol����v��C��=0.5/20=0.025 mol?L-1?min-1����A����B���ɱ������ݿ�֪��10s��A��Ũ�ȱ仯��Ϊ1mol-0.5mol=0.5mol���ɷ���ʽ��֪B��Ũ�ȱ仯��Ϊ2��0.5mol=1mol��10sʱBŨ��Ϊ0.2mol��10sʱ����ƽ�⣬�ɷ���ʽ��֪C��Ũ�ȱ仯��Ϊ0.5mol�����������������䣬��ʼʱ�������г���0.50 mol A�����0.60 mol B���壬��ЧΪԭƽ���������һ��������ѹǿ��A��ת���ʽ��ͣ���ƽ��ʱn��C����0.25 mol����B��ȷ��C���ڴﵽƽ��������С���������ѹǿ������B����Һ����ƽ�ⲻ�ƶ�����C����D���ɱ���ʱ���֪��10s��A�����ʵ����仯��Ϊ1mol-0.5mol=0.5mol��A��Ũ�ȱ仯��Ϊ0.5/2=0.25mol/L����
A��g��+2B��g��?C��g��
��ʼ��mol/L����0.5 0.6 0
�仯��mol/L����0.25 0.5 0.25
ƽ�⣨mol/L����0.25 0.1 0.25
�ʸ��¶���ƽ�ⳣ��k=0.25/(0.25*0.12)=100������ΪT2��ʱ��������Ӧƽ�ⳣ��Ϊ20�������¶ȣ�ƽ�����淴Ӧ���У�������ӦΪ���ȷ�Ӧ����D����ѡB��
���㣺���⿼���˷�Ӧ���ʼ��㡢Ӱ�컯ѧƽ�����ء���ѧƽ�ⳣ���ȣ��Ѷ��еȣ�ע��Bѡ����Ը���ƽ�ⳣ������C�ľ���ֵ��Cѡ��Ϊ�״��㡢�ѵ㣬��������ѹǿ����Һ����ѧ�������ԡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���淴ӦaA(g)+bB(g) cC(g)+dD(s)����H=QkJ��mol-1����Ӧ�����У���������������ʱ��ij�����ڻ�����еĺ������¶ȣ�T������Ӧ���ʣ�v����ѹǿ�Ĺ�ϵ��ͼ��ʾ����ͼ����������˵����ȷ����
cC(g)+dD(s)����H=QkJ��mol-1����Ӧ�����У���������������ʱ��ij�����ڻ�����еĺ������¶ȣ�T������Ӧ���ʣ�v����ѹǿ�Ĺ�ϵ��ͼ��ʾ����ͼ����������˵����ȷ����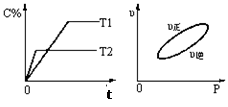
| A��T1��T2��Q��0 |
| B������ѹǿ��B��ת���ʼ�С |
| C������Ӧ��ƽ��ʱ�����������ܶȲ��ٱ仯 |
| D��a+b��c+d |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ�̶��ݻ����ܱ������У����淴Ӧ�� H2(g) + I2(g) 2HI (g)�ﵽƽ��ı�־��
2HI (g)�ﵽƽ��ı�־��
| A��H2��I2��HI�ķ�����֮��Ϊ1��1��2 |
| B������������ɫ���ٷ����仯 |
| C����λʱ������n mol H2��ͬʱ���ij�2n mol HI |
| D�����������ܶȱ��ֲ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����ΪV L�ĺ����ܱ�������ʢ��һ����H2��ͨ��Br2(g)�� ����Ӧ��H2(g)��Br2(g)  2HBr(g)����H<0�����¶ȷֱ�ΪT1��T2��ƽ��ʱ��H2�����������Br2(g)�����ʵ����仯��ϵ��ͼ��ʾ������˵����ȷ����
2HBr(g)����H<0�����¶ȷֱ�ΪT1��T2��ƽ��ʱ��H2�����������Br2(g)�����ʵ����仯��ϵ��ͼ��ʾ������˵����ȷ����
| A����ͼ��֪��T2>T1 |
| B��a��b����ķ�Ӧ���ʣ�b>a |
| C��Ϊ�����Br2(g)��ת���ʣ��ɲ�ȡ����Br2(g)ͨ�����ķ��� |
| D��T1ʱ������Br2(g)���룬ƽ��ʱHBr����������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�ں��¡���ѹ�£�a mol A��b molB��һ���ݻ��ɱ�������з�����Ӧ��A��g�� +2B��g�� 2C��g����һ��ʱ���ﵽƽ�⣬����n mol C������˵����ȷ��
2C��g����һ��ʱ���ﵽƽ�⣬����n mol C������˵����ȷ��
A������A��B��ת����֮��Ϊl��2
B����ʼʱ�̺ʹﵽƽ��������е�ѹǿ֮��Ϊ��a+b������a+b-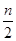 ��
��
C����v����A��=v����B��ʱ����Ӧһ���ﵽƽ��״̬
D������������壬ƽ�����淴Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ���¶��£�������X������Y��0��16mol����10L�����ܱ������У�������Ӧ
X(g)��Y(g)  2Z(g) ��H < 0, һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±���
2Z(g) ��H < 0, һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±���
����˵����ȷ����
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0��12 | 0��11 | 0��10 | 0��10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������������ͼ��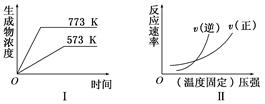
���з�Ӧ�з�������ͼ�����(���� )
A��N2(g) �� 3H2(g) 2NH3(g)�� ��H��0 2NH3(g)�� ��H��0 |
B��2SO3(g) 2SO2(g) �� O2(g)����H��0 2SO2(g) �� O2(g)����H��0 |
C��4NH3(g) �� 5O2(g) 4NO(g) �� 6H2O(g)����H��0 4NO(g) �� 6H2O(g)����H��0 |
D��H2(g) �� CO2(g)  CO(g) �� H2O(g)����H��0 CO(g) �� H2O(g)����H��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���������������˹��ϳɵ��л����ҵ����������CO2��NH3��һ�������ºϳɣ��䷴Ӧ����ʽΪ2NH3+CO2 CO(NH2)2+H2O������̼��
CO(NH2)2+H2O������̼��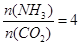 ��CO2��ת������ʱ��ı仯��ϵ����ͼ��ʾ������˵��������ǣ� ��
��CO2��ת������ʱ��ı仯��ϵ����ͼ��ʾ������˵��������ǣ� ��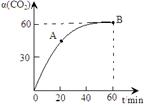
| A���÷�Ӧ��60minʱ�ﵽƽ��״̬ |
| B��NH3��ƽ��ת����Ϊ30% |
| C�����Ӱ�̼�ȿɽ�һ�����CO2��ƽ��ת���� |
| D��A����淴Ӧ���ʦ���(CO2)����B�������Ӧ���ʦ���(CO2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
Ϊ��СCO2�Ի�����Ӱ�죬�ڳ�������̼����ͬʱ�������ǿ��CO2�������õ��о���T1��ʱ����9molCO2��12molH2����3L�ܱ������У�������ӦCO2(g)+3H2(g) CH3OH(g)+H2O(g) ��H<0��������CH3OH�����ʵ�����ʱ��仯������I��ʾ��ƽ��ʱ������ѹǿΪP1���ı�ijһ�������½���������Ӧ��CH3OH�����ʵ�����ʱ��仯������II��ʾ������˵���������(����)
CH3OH(g)+H2O(g) ��H<0��������CH3OH�����ʵ�����ʱ��仯������I��ʾ��ƽ��ʱ������ѹǿΪP1���ı�ijһ�������½���������Ӧ��CH3OH�����ʵ�����ʱ��仯������II��ʾ������˵���������(����)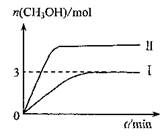
| A������II��Ӧ�������ı�������ѹǿ |
| B��T2��ʱ��������Ӧƽ�ⳣ��Ϊ0.42����T2>T1 |
| C����T1�棬����ʼʱ�������г��� 5 mol CO2��5 mol H2��5 mol CH3OH(g)��5 mol H2O(g)�����ƽ��ǰv(��)>v(�棩 |
D����T1�棬����ʼʱ�������г���4.5molCO2��6mol H2 ,ƽ��ʱ������ѹǿp= |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com