
����Ŀ��ij��ѧ��ȤС����100mL 1mol/L NaOH��Һ��ȫ������a mol CO2��õ���ҺA��Һ������ޱ仯����Ϊ��ȷ����ҺA�����ʳɷּ�aֵ������ȤС���ͬѧ����������ʵ�飮������������������Ӧʵ�����ݣ�
��1��[�������] �������ҺA������ΪNaOH��Na2CO3��
�������ҺA������ΪNa2CO3��
�������ҺA������ΪNa2CO3��NaHCO3��
���������ҺA������Ϊ ��
��2��[ʵ�����] ��i����ͬѧȡ������ҺA���Թܣ������Թ��еμӼ��η�̪��Һ����ҺA��죬�ɴ˵ó�����I������
��ii����ͬѧ��������Ϊ��ͬѧ��ʵ����������������ӷ���ʽ˵����ͬѧ���ж�����������һ�������Ӧ��ȡ������Һ�������м�����������Һ����������ҺA�Ƿ� �� ������������Һ��۲쵽��ҺA����ǣ�
��iii����ͬѧΪ�˼�����ҺA�Ƿ��������ʣ�������ͬѧ���û�����Һ���й��ˣ�������Һ��Ϊ���ݣ������е�һ�ݼ���ϡ���ᣬ����ɫ�������ɣ��������ȷ��
��iv��Ϊȷ�ⶨaֵ����ͬѧȡ��10mL ��ҺA����ƿ�У��õζ��������м���ijŨ�ȵ�ϡ���ᣬ��¼���������������������������������Ƴ���ͼ����a= �� ������������ʵ���Ũ��Ϊ �� 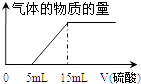
���𰸡�
��1��Na2CO3
��2��CO32��+H2O?HCO3��+OH�� ��HCO3��+H2O?H2CO3+OH����BaCl2��Na2CO3����![]() mol��
mol��![]()
���������⣺��100mL 1mol/L NaOH��Һ��ȫ������a mol CO2��õ���ҺA��Һ������ޱ仯����������̼������������Һ��Ӧ����̼���ƣ���Һ��Ϊ�������ƺ�̼���ƣ�������̼ǡ�ú�����������Һ��Ӧ����̼���ƣ�������̼���˵õ���Һ������Ϊ̼���ƺ�̼�����ƣ�������̼������Ӧ����̼�����ƣ���1���������ҺA������ΪNaOH��Na2CO3���������ҺA������ΪNa2CO3���������ҺA������ΪNa2CO3��NaHCO3�����������ҺA������ΪNaHCO3�����Դ��ǣ�NaHCO3����2����ii����ͬѧȡ������ҺA���Թܣ������Թ��еμӼ��η�̪��Һ����ҺA��죬��Һ�ʼ��ԣ����ܵ�ԭ���Ǽ���������������̼������Һ��̼������ӡ�̼���������ˮ����Һ�Լ��ԣ������ӷ���ʽ˵����ͬѧ���ж�����Ϊ��CO32��+H2OHCO3��+OH�� ��HCO3��+H2OH2CO3+OH��������һ�������Ӧ��ȡ������Һ�������м����������Ȼ�����Һ���۲쵽��ҺA�������Ϊ�˼�����ҺA�к���̼���ƣ����Դ��ǣ�CO32��+H2OHCO3��+OH�� ��HCO3��+H2OH2CO3+OH����BaCl2��Na2CO3����iii����ͬѧ���û�����Һ���й��ˣ�������Һ��Ϊ���ݣ������е�һ�ݼ���ϡ���ᣬ����ɫ�������ɣ���̼��������Һ�����ᷴӦ���ɶ�����̼���壬����̼���ƺ�̼�����ƣ��������ȷ�����Դ��ǣ���iv��ͼ�������֪��ʼ������������5mL�����ɶ�����̼������������Ϊ10mL��֤����������Ϊ�����ʵ�����̼���ƺ�̼�����ƣ����ݻ�ѧ����ʽ������ϵ����õ���������Ũ��Ϊ��cmol/L��������ӦΪ��2Na2CO3+H2SO4=2NaHCO3+Na2SO4 �� 2NaHCO3+H2SO4=Na2SO4+2CO2��+2H2O�� ����Ԫ���غ���ʽ���㣺100mL 1mol/L NaOH��Һn��NaOH��=0.1mol��ȡ10mL��Һ�к��������������ʵ���Ϊ0.01mol������Ũ��Ϊc��
�õ�0.015L��c��2=0.01mol
c= ![]() mol/L������ͼ���֪NaHCO3��������10mL��
mol/L������ͼ���֪NaHCO3��������10mL��
2NaHCO3+ | H2SO4 | = | Na2SO4+ | 2CO2��+ | 2H2O |
2 | 1 | ||||
n | ��0.015L��0.005L���� |
n= ![]() mol
mol
100mL��Һ������̼�غ�õ�������̼���ʵ���a= ![]() mol��10=
mol��10= ![]() mol��
mol��
���Դ��ǣ� ![]() mol��
mol�� ![]() mol/L��
mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T Kʱ����2.0L�����ܱ������г���0.10molCOCl2��������Ӧ![]() ������һ��ʱ���Ӧ�ﵽƽ�⡣��Ӧ�����в�õIJ������ݼ��±�������˵����ȷ����
������һ��ʱ���Ӧ�ﵽƽ�⡣��Ӧ�����в�õIJ������ݼ��±�������˵����ȷ����

A. T Kʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ![]()
B. ��Ӧ��ǰ2s��ƽ������![]() mol��L-1��s-1
mol��L-1��s-1
C. ���������������䣬�����¶ȣ�����ƽ��ʱc(C12)=0.038mol��L-1����Ӧ�ġ�H<0
D. ƽ����������������ٳ���0.10molCOCl2��ƽ�������ƶ���COCl2��ת��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��������þ���������Ͷ��2molL��1�������У���������ȫ�ܽ������Һ�м���2molL��1������������Һ�����ɳ������������������������Һ�������ϵ��ͼ��ʾ���� 
��1����80��90mL��Ӧ��Ӧ�����ӷ���ʽ ��
��2��������������Ϊ
��3������������mL��
��4��a��ȡֵ��Χ�� ��
��5��n��Mg��/n��Al�������ֵ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E��X����ѧ���������������ͼת����ϵ������������ͷ�Ӧ������ȥ���� 
��1����AΪ�����Ľ������ʣ���ɫ��Ӧ�ʻ�ɫ��X��ʹƷ����Һ��ɫ��д��E�к��еĻ�ѧ����������֪1molA��ˮ��Ӧ�ų�283.5kJ����������д��A��ˮ��Ӧ���Ȼ�ѧ��Ӧ����ʽ��
��2����A Ϊ������Ԫ����ɵĵ��ʣ���Ԫ�ص�����������ˮ����������ǿ������A��H2O��Ӧ�����ӷ���ʽ ��
��3����A Ϊ����ɫ��ĩ���ش��������⣺ ��1molA��������H2O��ַ�Ӧʱ��ת�Ƶ�������Ϊ
����XΪ�ǽ������ʣ�ͨ��Ϊ��ɫ��ĩ��д��D�Ľṹʽ
��4����AΪ�����X��Fe����ҺD����KSCN��Һ��죮 ��A��H2O��Ӧ�����ӷ���ʽ
���������ӷ���ʽ��ʾD�εľ�ˮԭ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ӵ���Ѿ���Ϊ��һ��ʵ�û������أ��õ�ؾ��������ܶȴ�ѹ�ߵ����ԡ�����ӵ�طŵ�ʱ�缫��ӦʽΪ������Ӧ��C6Li��xe��==C6Li1��x��xLi+��C6Li��ʾ�ԭ��Ƕ��ʯī�γɸ��ϲ��ϣ�������Ӧ��Li1��xMO2��xLi+��xe��==LiMO2��LiMO2��ʾ��﮵Ĺ��ɽ��������
��1��﮵�طŵ�ʱ��صķ�ӦʽΪ_____________________________��
��2���õ�ع���ʱ��Li+��________�����������������Ǩ�ơ�
��3������ŵ���������ĸ�������5.6g����ת�Ƶĵ�����ĿΪ_______��NAΪ�����ӵ�������ֵ����
��ѧ����������̫���ܵ�ص��ˮ�����������Ƴ�ȼ�ϵ�ظ����dz�磬�ɽ��������͵����ǹ���ϵͳ��
��4����֪�ƻ�1molH-H����1molO=O����1molH-O��ʱ�ֱ���Ҫ����436kJ��498kJ��465kJ����������ͼ��ʾH2��O2ת��Ϊˮ�ķ�Ӧ���������仯����b=______��
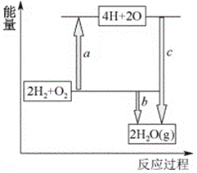
��5����������ȼ�ϵ�صĵ������ҺΪ������Һ������ܷ�ӦΪ2H2+O2=2H2O���õ�ص�������ӦΪ________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ����ȡ����Ӧ����
A.�Ҵ��ڿ�����ȼ��
B.���������£�����������������Ӧ
C.��ϩʹ������Ȼ�̼��Һ��ɫ
D.�����������������£���������������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��613C��NMR(�˴Ź���)�������ں�̼������Ľṹ������613C��ʾ��̼ԭ��(����)
A.������13������B.������6�����ӣ�������7������
C.������Ϊ13��������7������D.������Ϊ13��������7������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���������������ϡ�����ʵ�ַ�ú�ң���SiO2��Al2O3��Fe2O3��CaO��MgO�ȣ��ۺ����õ��¹��ա���ҵ�������£�
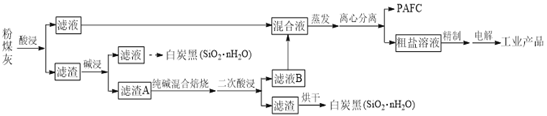
�ش��������⣺
��1���ۺ��Ȼ�������PAFC����ѧʽΪ[Al2(OH)nCl6��n]m��[Fe2(OH)xCl6��x]y����һ������Ч�ľ�ˮ����PAFC����Ԫ�صĻ��ϼ�Ϊ___________��
��2����һ���������е�����________________���ѧʽ����
��3��ʵ�ʹ�ҵ�С��������������������ܳ�ַ�Ӧ������A����Ҫ����SiO2��Al2O3���������ϱ��ա��У����Ƿֱ�����Ӧ�Ļ�ѧ����ʽΪ__________��________��
��4������ҺB������Ҫ������_________���ѧʽ������Һ��Ϻ���������������__________________��
��5������⡱ʱ�����ĵ缫��ӦʽΪ_______________��
��6��PAFC����ˮAlCl3��FeCl3��6H2O������Ϊ25 mg��![]() ʱ��������ͬpH��ˮ���Ƕ�ȥ������ͼ��ʾ��PAFC���ŵ���________��
ʱ��������ͬpH��ˮ���Ƕ�ȥ������ͼ��ʾ��PAFC���ŵ���________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫ��ѧ���ڻ�ѧ��Ӧ�������ԭ�Ӿ�������(ԭ�ӽ�Լ)���¸��Ҫ�������ԭ�Ӿ����Է�Ӧ��ԭ�Ϸ����е�ԭ��ȫ��ת��������Ҫ�IJ�������������ʵ�����ŷš����з�Ӧ��������ȫ����Ҫ�����(����)
A. �ֽⷴӦ B. ȡ����Ӧ C. ���ֽⷴӦ D. ���Ϸ�Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com