
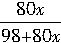 ×100%=20%
×100%=20%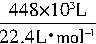 ×10%=2×103mol。
×10%=2×103mol。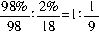 ,故可将其表示为H2SO4?H2O/9或SO3?10H2O/9。则98%的浓硫酸吸收SO3生产发烟硫酸的反应可表示为:
,故可将其表示为H2SO4?H2O/9或SO3?10H2O/9。则98%的浓硫酸吸收SO3生产发烟硫酸的反应可表示为: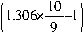 SO3=1.306×10SO3/9?10H2O/9
SO3=1.306×10SO3/9?10H2O/9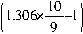 mol
mol

 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)设上述工厂只生产发烟H2SO4:
①算出1
②算出每1
(2)设上述工厂只生产98%的H2SO4:
①算出每1
②算出同时生产的98% H2SO4的质量。
注:上述气体体积均转化为标准状况下的体积。
(3)若该工厂同时生产发烟硫酸和98%硫酸(两种产物的质量比x=m1/m2,m1和m2分别是发烟硫酸和98%硫酸的质量)。
导出数学表达式,用来描述每1 000 m3出口气体中所消耗水的质量同上述x间的关系。
说明问题(1)和问题(2)中得到的有关数据是否符合你导出的数学表达式。
查看答案和解析>>
科目:高中化学 来源: 题型:
请计算(计算结果保留三位有效数字):
(1)若发烟硫酸用H2SO4·xSO3表示,则x的值是_______;
(2)若只用水吸收SO3(假设吸收完全)生产该发烟硫酸,求出448 m3(已折算成标准状况)“出口气体”所需要用水的质量;
(3)若只用98%的浓H2SO4来完全吸收SO3生产发烟硫酸,计算出448 m3(已折算成标准状况)“出口气体”所需要用98%的浓H2SO4的质量。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市重点中学高一(下)期末化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com