
以乙炔或苯为原料可合成有机酸H2MA,并进一步合成高分子化合物PMLA。
I.用乙炔等合成烃C。
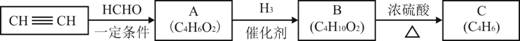
已知:

(1)A分子中的官能团名称是_______、_______。
(2)A的一种同分异构体属于乙酸酯,其结构简式是________________
(3)B转化为C的化学方程式是________________________________________,其反应类型是_______。
II.用烃C或苯合成PMLA的路线如下。
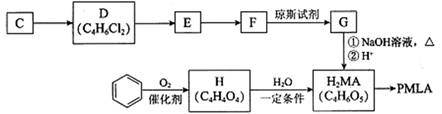
已知:

(4)1 mol有机物H与足量NaHCO3溶液反应生成标准状况下的CO2 44.8 L,H有顺反异构,其反式结构简式是________________
(5)E的结构简式是________________
(6)G与NaOH溶液在加热条件下反应的化学方程式是_________________________
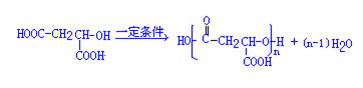
(7)聚酯PMLA有多种结构,写出由H2MA制PMLA的化学方程式(任写一种)________________________________________________________________________
【知识点】有机合成、结构简式、有机反应方程式
【答案解析】 (1)羟基、碳碳三键。
(2)CH3COOCH=CH2
(3)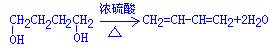 消去反应
消去反应
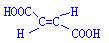
(4)
(5)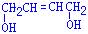
(6)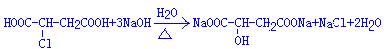
(7)
解析:(1)根据已知反应,乙炔和醛反应后,官能团有碳碳三键和羟基。
(2)A的分子式是C4H6O2,又属于乙酸酯,其结构简式是CH3COOCH=CH2
(3)B为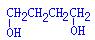 转化为C4H6,浓硫酸加热的条件,所以是消去反应。
转化为C4H6,浓硫酸加热的条件,所以是消去反应。

(4)1 mol有机物H与足量NaHCO3溶液反应生成标准状况下的CO2 44.8 L,说明1分子H含有2个羧基,H有顺反异构说明含有双键,根据分子式得反式结构简式是
(5)根据逆合成分析,E分子中的2个羟基在碳链的两端得E的结构简式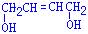
(6)根据逆合成分析,H2MA为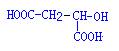 ,G是琼斯试剂反应后得到的羧酸,G与NaOH溶液在加热条件下反应,是卤代烃的水解反应,还有酸碱的中和反应,综上得
,G是琼斯试剂反应后得到的羧酸,G与NaOH溶液在加热条件下反应,是卤代烃的水解反应,还有酸碱的中和反应,综上得
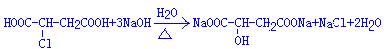
(7)聚酯PMLA有多种结构,所以是缩聚反应。H2MA分子式为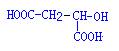 ,得化学方程式
,得化学方程式
【思路点拨】本题考查了官能团的判断和性质,卤代烃的反应,合成高分子的反应,题目难度中等,注意逆合成分析法的应用和官能团的引入以及消去反应。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
若溶液中由水电离产生的c(OH﹣)=1×10﹣14mol•L﹣1,满足此条件的溶液中一定可以大量共存的离子组是( )
|
| A. | Al3+ Na+NO3﹣ Cl﹣ | B. | K+ Na+Cl﹣ NO3﹣ |
|
| C. | K+ Na+ Cl﹣AlO2﹣ | D. | K+ NH4+ SO42﹣NO3﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.含碳元素的化合物都是有机物
B.完全燃烧只生成CO2和H2O的化合物都是烃
C.大多数有机物分子中碳原子与碳原子之间或碳原子与其他原子之间相结合的化学键是非极性共价键和极性共价键
D.有机物完全燃烧只可能生成CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
F1 F2 F3 G4 H3【2014·宁夏银川一中三模】(14分)
运用化学反应原理知识回答下列有关碳和碳的化合物的问题:
(1)汽车尾气的主要污染物是NO以及燃料燃烧不完全所产生的CO,它们是现代化城市的重要大气污染物,为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应△H<0). 在2 L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|
T/℃ n/mol | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
①请结合上表数据,写出NO与CO反应的化学方程式 .
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,根据表中数据计算K1= 。根据表中数据判断,温度T1和T2的关系是(填序号)__________。
A.T1>T2B.T1<T2 C.T1=T2 D.无法比较
(2)反应生成的气体E经常用氢氧化钠来吸收,现有0.4molE,若用200mL 3mol/L NaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: .
(3)已知CH4、H2和CO的燃烧热分别为890.3kJ/mol,285.8 kJ/mol和283.0 kJ/mol,工业上利用天然气(主要成分是CH4)与CO2进行高温重整制备CO和H2,写出该反应的热化学方程式: .
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质,CO为负极燃气,空气与CO2 的混合气为正极助燃气,制得在 650 ℃下工作的燃料电池,写出其负极和正极电极反应方程式:负极: ;正极: .
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F、G为原子序数依次递增的7种短周期主族元素。A、B元素的最高正价与最低负价的代数和均为零;C元素是植物生长三大营养元素之一;D的单质具有强氧化性,其氢化物能和一种半导体材料反应生成常温常压下的两种气体;E原子核外K层电子数与M层电子数相等;F原子的价电子数等于电子层数的两倍。请回答下列问题:
(1)CD3 的电子式为 ;
(2)用离子方程式表示G 的非金属性比F强 ;
(3)EF在空气中充分灼烧生成一种稳定性的盐,则此反应方程式为 ;
(4)C的氢化物与G的单质以物质的量之比1:3反应,生成二元化合物X和一种气体,该气体遇氨气产生“白烟”,则X的化学是为 ,X与水反应的产物名称是
;
(5)已知充分燃烧一定量的B2A2放出Q kJ的能量,燃烧生成的产物恰好与100ml 5 mol·L-1的NaOH溶液完全反应生成正盐,则燃烧1mol B2A2放出的热量为 KJ;


(6)常温下,E(OH)2在水中的沉淀溶解平衡曲线如图所示(单位mol·L-1)。要使c(E2+) 为0.001 mol·L-1的溶液形成沉淀,则溶液的PH值至少升高到 。
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求完成下列各小题
(1)按系统命名法,化合物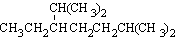 的名称是____________________。
的名称是____________________。
(2)蛋白质是构成生命的基础物质,而氨基酸又是构成蛋白质的基石,最简单的氨基酸其
结构简式是 ;该氨基酸形成的二肽的结构简式是 ;将该氨基酸溶于酸性溶液形成的微粒的结构简式是 ;将该氨基酸溶于碱性溶液形成的微粒的结构简式是 ;固态氨基酸主要以内盐形式存在,该氨基酸的内盐的结构简式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
1体积某气态烃和2体积氯化氢发生加成反应后,最多还能和6体积氯气发生取代反应。由此可以断定原气态烃是(气体体积均在相同条件下测定)( )
A.乙炔 B.丙炔 C.丁烯 D.丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关Cl、N、S等非金属元素化合物的说法正确的是( )
A.漂白粉的成分为次氯酸钙
B.实验室可用浓硫酸干燥氨气
C.实验室可用NaOH溶液处理NO2和HCl废气
D.Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com