
| A. | 铁片、石墨棒,稀硫酸 | B. | 铜片、石墨棒,硝酸银溶液 | ||
| C. | 锌片、铜片,稀盐酸 | D. | 铜片、银片,CuSO4溶液 |
分析 根据原电池的构成条件判断是否能构成原电池,原电池的构成条件是:1、有两种活泼性不同的金属(或其中一种为非金属导体)作电极;2、电极均插入电解质溶液中;3、两极相互连接(或接触);4、能自发的发生氧化还原反应.
解答 解:A.两电极的活泼性不同,且铁片与稀硫酸能自发的发生氧化还原反应,所以能构成原电池,故A不选;
B.两电极的活泼性不同,且铜片与硝酸银溶液能自发的发生氧化还原反应,所以能构成原电池,故B不选;
C.两金属的活泼性不同,且锌片与稀盐酸能自发的发生氧化还原反应,所以能构成原电池,故C不选;
D.两金属的活泼性不同,但活泼的铜片不能与硫酸铜自发的发生氧化还原反应,所以不能构成原电池,故D选.
故选D.
点评 本题考查了原电池的设计,为高频考点,侧重于学生的分析能力以及双基的考查,难度不大,根据原电池的构成条件分析判断即可.


科目:高中化学 来源: 题型:解答题
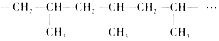 其重复结构单元即它的链节是
其重复结构单元即它的链节是 .
.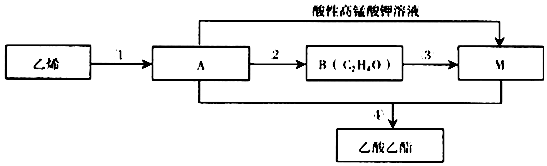
 ,由A生成B的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
,由A生成B的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O. CH3COOCH2CH3+H2O,除去乙酸乙酯中混有A和M的方法通入饱和碳酸钠溶液吸收.
CH3COOCH2CH3+H2O,除去乙酸乙酯中混有A和M的方法通入饱和碳酸钠溶液吸收.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
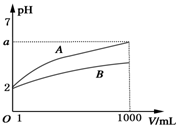 pH=2的A、B两种酸溶液各取1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是( )
pH=2的A、B两种酸溶液各取1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是( )| A. | 稀释后A溶液的酸性比B溶液弱 | |
| B. | a=5时,A是强酸,B是弱酸 | |
| C. | 若A、B都是弱酸,则5>a>2 | |
| D. | A、B两种酸溶液物质的量浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
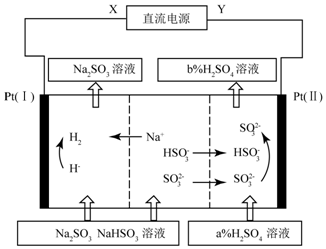
| A. | X为直流电源的正极,Y为直流电流的负极 | |
| B. | 图中的b<a | |
| C. | P(I)附近溶液的pH减小,Pt(II)附近溶液的pH增大 | |
| D. | 再生机理为:Pt(I)H+放电,导致“HSO3-?SO2-+H+”平衡右移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑦ | B. | ①②⑤⑦ | C. | ①②④⑤⑦ | D. | ②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为电池负极,发生氧化反应 | |
| B. | 电池工作时,氧气与锌直接化合,生成氧化锌 | |
| C. | 正极发生的反应是:$\frac{1}{2}$O2+2e-+2H+═H2O | |
| D. | 负极发生的反应是:Zn-2e-+H2O═ZnO+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
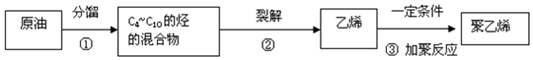
| A. | 石油是各种液态烃的混合物 | |
| B. | 常压分馏的原料是重油 | |
| C. | 由分馏塔分馏出的各馏分均是混合物 | |
| D. | 减压分馏的主要产品有汽油、润滑油、煤油和沥青 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
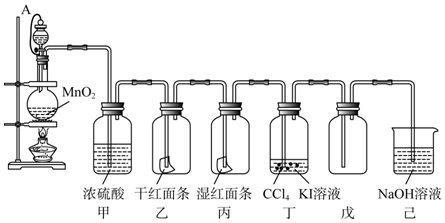
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀硫酸溶解四氧化三铁:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | Ca(HCO2)2溶液中滴加Ba(OH)2溶液至呈中性:Ca2++2HCO3-+Ca2++2OH-═2H2O+BaCO3↓+CaCO3↓ | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| D. | 向次氯酸钠溶液中通入SO2:2ClO-+SO2+H2O═SO32-+2HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com