
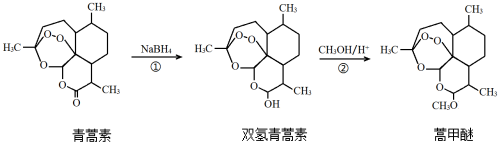
| A. | 利用黄花蒿叶研究青蒿素结构的基本步骤为:分离、提纯→元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式 | |
| B. | 双氢青蒿素在水中的溶解性大于青蒿素 | |
| C. | ①、②的反应类型分别为还原反应、取代反应 | |
| D. | 青蒿素转化为双氢青蒿素,手性碳个数不变 |
分析 A.研究有机物一般经过:分离、提纯→确定实验式→确定分子式→确定结构式,然后根据元素定量分析确定实验式、在测定相对分子质量确定分子式,最后通过波谱分析确定结构式;
B.双氢青蒿素含有羟基,可形成氢键;
C.①中C=O生成C-O键,②该反应中醇羟基变为醚键;
D.青蒿素手性碳原子如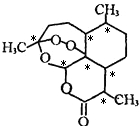 ,所以有7个;双氢青蒿素分子内含有8个手性碳原子.
,所以有7个;双氢青蒿素分子内含有8个手性碳原子.
解答 解:A.研究有机物一般经过:分离、提纯→确定实验式→确定分子式→确定结构式,然后根据元素定量分析确定实验式、在测定相对分子质量确定分子式,最后通过波谱分析确定结构式,故A正确;
B.双氢青蒿素含有羟基,可形成氢键,在水中溶解度较大,故B正确;
C.①中C=O生成C-O键,为还原反应,②该反应中醇羟基变为醚键,为取代反应,故C正确;
D.青蒿素手性碳原子如 ,所以有7个;双氢青蒿素分子内含有8个手性碳原子,比青蒿素中多连接羟基的碳原子,故D错误;
,所以有7个;双氢青蒿素分子内含有8个手性碳原子,比青蒿素中多连接羟基的碳原子,故D错误;
故选D.
点评 本题考查有机物的结构与性质,为高考常见题型,侧重学生的分析能力的考查,注意把握有机物的官能团与性质的关系,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 必为第1层 | B. | 只能是第2层 | C. | 只能是第3层 | D. | 可以是任意层 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲硫醇(CH3SH)比甲醇(CH3OH)的熔点低的原因是甲醇分子间易形成氢键 | |
| B. | N-O键的极性比C-O键的极性小 | |
| C. | 氨易液化与氨分子间存在氢键有关 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质水溶的导电能力强,该物质一定是强电解质 | |
| B. | 胶体区别于其他分散系的本质特征是丁达尔现象 | |
| C. | 往Fe(OH)3胶体中逐滴加入稀H2SO4溶液时,开始时会出现沉淀,再继续滴加时,沉淀又会消失 | |
| D. | 氢氧化铁胶体电泳时阴极颜色加深,证明氢氧化铁胶体带正电 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 青铜、不锈钢和硬铝都是合金 | |
| B. | 铝可用于制造燃烧弹和信号弹 | |
| C. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用,因此铝罐可久盛食醋 | |
| D. | 铜锈的主要成分是Cu2(OH)2CO3,可以用稀盐酸除铜锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol.回答有关中和反应的问题.
已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol.回答有关中和反应的问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNH3和 1molHCl混合 | |
| B. | 1mol NO和 0.5 molO2混合 | |
| C. | 1molSO2和 1 molH2S混合 | |
| D. | 等体积的NO和NO2被足量烧碱溶液吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com