
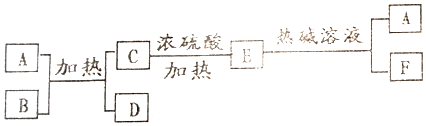
分析 A的焰色反应呈紫色(透过蓝色钴玻璃),说明A中含有K元素;D、E为气体单质,且D是植物光合作用的产物之一,则D是O2;
E的组成元素的最高价氧化物对应水化物的酸性最强的无机含氧酸,则E是Cl2,G中B是不溶于水的黑色固体,则A中含有K、Cl元素,A和B的反应为氯酸钾在二氧化锰作催化剂条件下的分解反应,则A是KClO3、B是MnO2,C是KCl和二氧化锰,F是KCl,结合题目分析解答.
解答 解:A的焰色反应呈紫色(透过蓝色钴玻璃),说明A中含有K元素;D、E为气体单质,且D是植物光合作用的产物之一,则D是O2;
E的组成元素的最高价氧化物对应水化物的酸性最强的无机含氧酸,则E是Cl2,G中B是不溶于水的黑色固体,则A中含有K、Cl元素,A和B的反应为氯酸钾在二氧化锰作催化剂条件下的分解反应,则A是KClO3、B是MnO2,C是KCl和二氧化锰,F是KCl,
(1)B的化学式为MnO2,故答案为:MnO2;
(2)C是KCl和二氧化锰,KCl能溶于水,而二氧化锰不溶于水,所以将C中物质分离开的操作是溶解、过滤,故答案为:溶解、过滤;
(3)E是氯气,氯气和热的NaOH溶液反应生成氯酸钾和氯化钾,离子方程式为3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$ClO3-+5Cl-+3H2O,
故答案为:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$ClO3-+5Cl-+3H2O.
点评 本题考查无机物推断,为高频考点,侧重考查学生分析推断及对元素化合物知识的综合运用,根据物质特殊颜色、特殊性质结合物质之间的转化分析推断,注意:氯气和热碱溶液反应生成氯酸盐,和冷的碱液反应生成次氯酸盐,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5KJ•mol-1(燃烧热) | |
| B. | C2H5OH+3O2═2CO2+3H2O△H=-1368.8KJ•mol-1(反应热) | |
| C. | 2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O (l)△H=-114.6KJ•mol-1(中和热) | |
| D. | 2H2O(g)═2H2(g)+O2(g)△H=+483.6KJ•mol-1(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的分解速率和Y的生成速率相等 | |
| B. | 单位时间内生成nmolZ,同时生成nmolX | |
| C. | 反应体系的总质量保持不变 | |
| D. | X、Y、Z的浓度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙溶于盐酸:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 钠投入水中:Na+H2O═Na++2OH-+H2↑ | |
| C. | 铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氢氧化钡溶液滴入稀硫酸中:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难溶电解质的溶度积越小,溶解度越大 | |
| B. | 可以通过沉淀反应使杂质离子完全沉淀 | |
| C. | 难溶电解质的溶解平衡是一种动态平衡 | |
| D. | AgCl固体在等浓度的NaCl、CaCl2溶液中的溶解度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com